
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория (модель) активированного комплекса
|
|
|
|
Константы скоростей химических реакций
Успешная работа таких программ по предсказанию химических процессов требует знания констант скоростей. Теоретические методы их определения пока работают лишь для простейших систем. Для обработки и систематизации экспериментальных данных (основного источника k) до сих пор используется эмпирическое уравнение Аррениуса
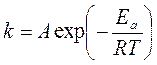 (3.62)
(3.62)
где Ea – энергия активации, A – предэкспоненциальный множитель.
В нижеследующей табличке представлены примеры экспериментально найденных кинетических констант.
| Уравнение реакции | Среда | Порядок реакции | A | Eа, кДж/моль |
| C2H5Br = C2H4 + HBr | газ | 7,2×10–12 c–1 | 218,0 | |
| H2 + C2H4 = C2H6 | газ | 4×107 м3/(моль×c) | 180,5 | |
| CH3Br + J– = CH3J + Br– | р-р H2O | 1,7×107 м3/(моль×c) | 76,6 |
Углубленное представление об элементарном акте химических реакций дает теория или модель активированного комплекса (МАК). При этом предполагается, что при сближении реагирующих молекул наблюдается почти непрерывный переход из начального в конечное состояние, который протекает через переходное состояние или активированный комплекс ( АК ) с максимумом потенциальной энергии Епот. Разность Епот активированного комплекса и исходных веществ, своеобразный энергетический барьер, названа энергией активации Еа реакции.
Еа определяется по Епот как функции взаимных расстояний всех участвующих в реакции атомов. Для линейного расположения атомов А, В и С простой реакции: А + ВС → (А∙В∙С)¹→АВ + С результатквантово-химическогорасчёта Епот от межъядерных расстояний
| х B – C и х A - B можно наглядно отобразить в виде диаграммы потенциальных кривых. Наиболее вероятный путь реакции (при наименьшей затрате энергии) ведет через состояние активированного комплекса. Изменение Епот вдоль координаты реакции схематично показано на рис.3.3 
| |||
| Рис.3.3. Потенциальная энергия вдоль координаты реакции |
Обозначим стехиометрические коэффициенты реагентов n' i º ai, а переходное состояние активированного комплекса A ¹, тогда химическое уравнение однобарьерной реакции
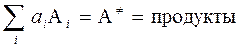 . (3.63)
. (3.63)
Определяющий постулат МАК (Эйринг, Поляни):
"Скорость реакции равна концентрации c ¹ активированного комплекса на вершине барьера, помноженной на частоту ν ¹ пересечения этого барьера."
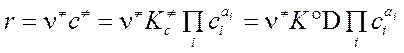 . (3.64)
. (3.64)
В (3.64) использованы: записанный для реагентов и АК «концентрационный» ТЗДМ 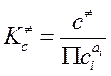 , взаимосвязь констант
, взаимосвязь констант 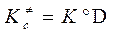 (см. ( 3.50 с )) и введено обозначение D = (RT/Р°)-Δν = (RT/P°) n -1,
(см. ( 3.50 с )) и введено обозначение D = (RT/Р°)-Δν = (RT/P°) n -1,
а Δν = 1 - n выражено через порядок реакции n.
Из сопоставления (3.64) с КЗДМ (3.58) константа скорости равна
k = ν ≠K° D. (3.65)
Активированный комплекс ( АК ) как неустойчивое переходное образование, в котором прежние химические связи еще не разорваны, а новые еще не до конца образовались, характеризуется избытком колебательных степеней свободы. При этом из константы равновесия K° можно выделить колебательную составляющую, определяющую переход через АК: K° = K≠ exp(–Δ G (ν ≠)/ RT ) ≈ K≠∙k Б T /(h ν ≠).
Подстановка полученного выражения в(3.65) дает окончательную формулу для константы скорости в МАК:
k = (k Б T/h) D K≠ = (k Б T/h) Dexp(- Δ rG≠/RT). (3.65')
k = (k Б T/h) D exp(- Δ rH≠/RT +Δ rS≠/R)(3.65'')
Сопоставление (3.65'') с формулой Аррениуса раскрывает смысл эмпирически введенных энергии активации, как энтальпии реакции перехода реагентов в АК, а также предэкспоненциального сомножителя, образованного универсальным частотным фактором и энтропией реакции перехода реагентов в АК.
Ea= Δ rH≠, A= (k Б T/h) D exp(Δ rS≠/R). (3.66)
Размерность константы скорости определяется размерностями входящих в А частотного фактора [ k Б T/h ] = 1/с и [D] = [ К ≠с].
Главное в том, что теоретическое выражение МАК определяет квантово-статистический способ расчета констант скоростей химических реакций. А самое замечательное при выводе − это сокращение постулируемой частоты пересечения барьера и выделенной из АК частоты слабейшего колебательного звена, определяющего реакционное преобразование компонентов.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 416; Нарушение авторских прав?; Мы поможем в написании вашей работы!

