
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Политропические процессы. Политропическими называются процессы, при которых теплоемкость тела остается постоянной
|
|
|
|
Политропическими называются процессы, при которых теплоемкость тела остается постоянной. Таким образом, условие, которое выполняется в ходе политропического процесса, заключается в том, что
 . (1.44)
. (1.44)
Найдем уравнение политропы для идеального газа. Напишем уравнение первого начала (1.13) для одного моля газа, представив δ Q в виде CdT, а dU – в виде 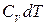
 . (1.45)
. (1.45)
В полученное уравнение входят все три параметра: p, V и T. Один из них можно исключить с помощью уравнения состояния. Чтобы получить уравнение политропы сразу в переменных p и V, исключим T. Для этого продифференцируем соотношение 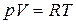
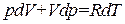 . (1.46)
. (1.46)
Исключив из уравнений (1.45) и (1.46) dT и произведя приведение подобных членов, получим
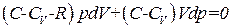 . (1.47)
. (1.47)
Заменив 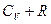 через
через 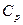 (см. (1.33)) и разделив (1.47) на pV, придем к дифференциальному уравнению
(см. (1.33)) и разделив (1.47) на pV, придем к дифференциальному уравнению
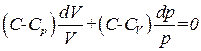 . (1.48)
. (1.48)
Величины C,  и
и  являются константами. Поэтому интегрирование уравнения (1.48) приводит к соотношению
являются константами. Поэтому интегрирование уравнения (1.48) приводит к соотношению
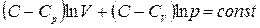 . (1.49)
. (1.49)
Разделив это соотношение на 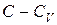 (что возможно, если
(что возможно, если  ) и, произведя потенцирование, получим
) и, произведя потенцирование, получим
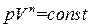 , (1.50)
, (1.50)
где
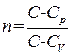 . (1.51)
. (1.51)
Уравнение (1.50) и есть искомое уравнение политропы идеального газа для случая, когда  . Величина n в (1.51) называется показателем поли-тропы.
. Величина n в (1.51) называется показателем поли-тропы.
| Процесс | n |
| Изобарический | |
| Изотермический | |
| Адиабатический | γ |
| Изохорический | 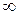
|
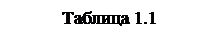 Чтобы установить характер политропического процесса при
Чтобы установить характер политропического процесса при  , обратимся к уравнению (1.49). При
, обратимся к уравнению (1.49). При  это уравнение принимает вид
это уравнение принимает вид 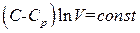 , откуда следует, что V в ходе процесса остается постоянным. Таким образом, политропический процесс с
, откуда следует, что V в ходе процесса остается постоянным. Таким образом, политропический процесс с  является изохорическим процессом. Это можно было предвидеть заранее, поскольку
является изохорическим процессом. Это можно было предвидеть заранее, поскольку  и представляет собой теплоемкость при постоянном объеме, т. е. при изохорическом процессе. Согласно (1.51) показатель политропы при изохорическом процессе стремится к бесконечности.
и представляет собой теплоемкость при постоянном объеме, т. е. при изохорическом процессе. Согласно (1.51) показатель политропы при изохорическом процессе стремится к бесконечности.
Остальные рассмотренные в предыдущем параграфе процессы также относятся к категории политропных процессов. Изобарическому процессу соответствует 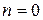 (см. (1.50)), изотермическому –
(см. (1.50)), изотермическому –  и, наконец, адиабатическому –
и, наконец, адиабатическому – 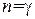 . Значения показателя политропы n для перечисленных процессов даны в табл. 1.1.
. Значения показателя политропы n для перечисленных процессов даны в табл. 1.1.
Решив уравнение (1.51) относительно C, получим формулу для теплоемкости идеального газа при политропическом процессе
 . (1.52)
. (1.52)
Подстановка 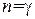 обращает выражение (1.52) в нуль (при проверке этого утверждения нужно принять во внимание формулу (1.35)). Следовательно, теплоемкость идеального газа при адиабатическом процессе равна нулю. При адиабатическом процессе теплоемкость равна нулю для всех тел. Это вытекает из того, что при адиабатическом процессе
обращает выражение (1.52) в нуль (при проверке этого утверждения нужно принять во внимание формулу (1.35)). Следовательно, теплоемкость идеального газа при адиабатическом процессе равна нулю. При адиабатическом процессе теплоемкость равна нулю для всех тел. Это вытекает из того, что при адиабатическом процессе 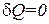 , в то время как dT отличен от нуля.
, в то время как dT отличен от нуля.
Подстановка  обращает выражение (1.52) в бесконечность. Таким образом, при изотермическом процессе теплоемкость бесконечно велика. Это объясняется тем, что при изотермическом процессе
обращает выражение (1.52) в бесконечность. Таким образом, при изотермическом процессе теплоемкость бесконечно велика. Это объясняется тем, что при изотермическом процессе 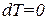 , в то время как
, в то время как 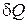 отличен от нуля.
отличен от нуля.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!