
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полиорганная недостаточность
|
|
|
|
ШОКА
МЕХАНИЗМЫ КАРДИОГЕННОГО
ПАТОФИЗИОЛОГИЧЕСКИЕ
| Острый инфаркт миокарда: потеря массы левого желудочка до критического уровня; правожелудочковая недостаточность. |
| ..... ψ |
| Механические осложнения: острая митральная регургитация, обусловленная разрывом или дисфункцией папиллярных мышц; разрыв межжелудочковой перегородки; разрыв стенки левого желудочка; аневризма левого желудочка. |
| t |
| Другие условия: последняя стадия кардиомиопатии; ушиб миокарда; острый миокардит; аортальный стеноз; обструктивная гипертрофическая кардиомиопатия; митральный стеноз; миксома или тромбоз предсердия; осложнения искусственного кровообращения. |
Клиническая картина типична: заостренные черты лица, серовато-бледные, иногда с циано-тичным оттенком, холодные, покрытые липким потом, кожные покровы; адинамия; больной почти не реагирует на окружающее. Пульс частый, нитевидный, иногда не прощупывается. АД нередко ниже
80 мм рт.ст., но у больных с исходной артериальной гипертензией симптомы шока могут появляться и при нормальных цифрах систолического АД (95—120 мм рт.ст.). Пульсовое давление 20—25 мм рт.ст. и ниже. Характерным симптомом, опасным в прогностическом отношении, является олигурия (анурия) до 20 мл в час и менее. К признакам шока относят метаболический ацидоз.
Исходя из особенностей возникновения шока, его клинической картины и эффективности лечения, выделяют следующие его формы: рефлекторный, истинный кардио-генный, ареактивный, аритмический [Чазов Е.И., 1992].
Рефлекторный шок. Развитие этой формы шока обусловлено рефлекторными изменениями и выраженным болевым синдромом, вызывающими нарушение регуляции сосудистого тонуса с последующим депонированием крови в сосудах и выход жидкой фракции крови в ин-терстициальное пространство, что приводит к уменьшению венозного притока к сердцу. Вследствие патологических рефлекторных влияний, особенно при инфаркте миокарда задней стенки, может развиться синусовая брадикардия — значительное сокращение MOC, снижение АД (до 90—100 мм рт.ст.), уменьшение опсс.
У больных с этой формой шока достаточный и быстрый эффект достигается адекватным обезболиванием и введением сосудистых средств (симпатомиметиков). Для обезболивания применяют наркотические анальгетики и препараты для нейролептаналгезии. Из симпатомиметиков чаще всего используют 1 % раствор мезатона (0,3—1 мл) или 0,2 % раствор норадреналина (2—4 мл) внутривенно капельно на изотоническом растворе натрия хлорида или 5 % растворе глюкозы методом титрования или вводят 25 мг допамина в 125 мл изотонического раствора натрия хлорида. При бра-
дикардии показано внутривенное введение 0,5—1 мл 0,1 % раствора атропина. Чтобы увеличить приток крови к сердцу, следует приподнять ноги больного на 15—20°. Проводят оксигенотерапию через носовой катетер или маску [Браунвальд E., 1995; Фомина И.Г., 1997].
Для повышения ОЦК, притока крови к сердцу, давления наполнения левого желудочка, CB и ликвидации артериальной гипотензии показано введение кровезаменителей. Предпочтительно использование реополиглюкина (200—400 мл со скоростью 20 мл/мин). Он улучшает реологические свойства крови и микроциркуляцию. Показана тром-болитическая терапия.
Истинный кардиогенный шок. В развитии этой формы шока основное значение приобретает резкое падение пропульсивной (сократительной) функции левого желудочка. Уменьшение MOC не компенсируется повышением ОПСС, что приводит к снижению АД. Систолическое АД ниже 90 мм рт.ст., у больных с артериальной гипертензией ниже 100 мм рт.ст.; пульсовое давление меньше 20 мм рт.ст. Возникают глубокие нарушения кровообращения во всех органах и тканях, развиваются олигурия, анурия.
При этой форме КШ уже в первые часы от начала инфаркта миокарда проводят обезболивающую и тромболитическую терапию, применяют лекарственные препараты, оказывающие положительное ино-тропное действие (в первую очередь катехоламины). Норадреналин в малых дозах оказывает преимущественно инотропное, а в высоких дозах — сосудосуживающее действие на миокард. Вводят препарат внутривенно капельно по 1—2 мг (0,5— 1 мл 0,2 % раствора) в 200 мл изотонического раствора натрия хлорида или 5 % раствора глюкозы. Скорость введения регулируется в зависимости от уровня АД (среднее АД 80—90 мм рт.ст.) и ритма сердца. АД
не должно быть выше 110—115 мм рт.ст. (у больных с предшествующей стойкой и высокой гипертензией — 130—140 мм рт.ст.). Средние дозы норадреналина от 4 до 16 мкг/мин. Показанием к его применению является KIII с низким ОПСС [Фомина H. Г., 1997].
При KUI эффективен также допа-мин, оказывающий положительное инотропное действие и уменьшающий сопротивление коронарных, мозговых, почечных, мезентериаль-ных сосудов. Вводят его внутривенно капельно со скоростью 2— 10 мкг/кг/мин под мониторным контролем, так как он может вызвать аритмию. Допамин разводят из расчета 25 мг на 125 мл или 200 мг на 400 мл 5 % раствора глюкозы или изотонического раствора натрия хлорида, т.е. в 1 мл последнего должно быть 200 или 500 мкг допа-мина. Начальная скорость введения 1—5 мкг/кг/мин (-200 мкг/мин).
У больных с не очень выраженной степенью гипотензии может оказаться полезным добутамин, который является синтетическим сим-патомиметическим амином, оказывающим в обычных дозах (2,5— 10 мкг/кг/мин) минимальное положительное инотропное и периферическое сосудосуживающее действие. Его не следует использовать в тех случаях, когда желательно добиться сосудосуживающего эффекта, и необходимо применять тогда, когда нежелательно положительное хро-нотропное действие (мало влияет на ЧСС). Начальная скорость внутривенного введения 2,5 мкг/кг/мин, вводят препарат каждые 15—30 мин, максимальная скорость инфузии 10—15 мкг/кг/мин [Браунвальд E., 1995].
Сердечные гликозиды при КШ у больных с инфарктом миокарда малоэффективны. Не оправдано и применение кортикостероидов.
При безуспешности медикаментозной терапии «истинного» КШ необходимо проводить контрпуль-
сацию. Важный метод лечения этого вида шока — восстановление крово-тока по окклюзированной венечной артерии (тромболизис, транслюми-нальная ангиопластика).
Ареактивный шок. О наличии этой формы шока говорят в тех случаях, когда введение возрастающих доз норадреналина или гипертензи-на в течение 15—20 мин не ведет к повышению АД. В настоящее время не удается достаточно эффективно лечить больных в шоковом состоянии, что обусловливает их высокую смертность.
Аритмический шок. В этих случаях отмечается четкая связь падения АД и появления периферических симптомов шока с нарушениями ритма и проводимости. При восстановлении сердечного ритма, как правило, исчезают и признаки шока. Первостепенная задача лечения — восстановление нормальной частоты желудочковых сокращений.
В остром периоде инфаркта миокарда аритмии возникают практически у каждого больного. Для профилактики желудочковых аритмий наиболее эффективен лидокаин. Вводят его внутривенно в первоначальной дозе 100—120 мг (5—6 мл 2 % раствора), а затем внутривенно капельно со средней скоростью 2— 4 мг/мин. При необходимости показано повторное струйное введение 60—100 мг лидокаина. Эту же дозу вводят при рецидиве экстрасисто-лии. Некоторые авторы указывают на прямое антигипоксическое действие лидокаина путем стабилизации клеточных мембран кардиоци-тов. Лидокаин оказывает очень слабое отрицательное инотропное влияние, при этом АД и CB существенно не меняются. Суточная доза препарата не более 2—3 г (у больных старше 70 лет при КШ, недостаточности кровообращения и нарушениях функции печени дозу уменьшают вдвое) [Сыркин А.Л., 1991].
При неэффективности лидокаина можно применить новокаинамид до
1 г под контролем ЭКГ и АД после каждых 100 мг (1 мл 10 % раствора) или блокаторы β-адренорецепторов (индерал из расчета 1 мг на 10 кг массы тела) внутривенно.
В последнее время считают, что лечение аритмий лучше начинать с быстрого определения и коррекции электролитных нарушений — гипо-калиемии и гипомагнезиемии. При гипокалиемии (уровень K+ менее 3,5 ммоль/л) 10 ммоль калия хлорида растворяют в 50—100 мл раствора глюкозы и вводят внутривенно ка-пельно в течение 30 мин. Введение этой дозы повторяется каждый час до достижения уровня K+ в плазме 4—4,5 ммоль/л. Меньшая степень гипокалиемии может быть скорри-гирована с помощью оральной терапии.
При гипомагнезиемии (уровень Mg2+ в плазме крови менее 0,7 ммоль/л) 1—2 г магния сульфата разводят в 50—100 мл изотонического раствора натрия хлорида и вводят в течение 50—60 мин, затем — от 0,5 до 1 г каждый час до 24 ч. Скорость и продолжительность инфузии зависят от клинической картины или степени магнезиемии. Введение раствора магния сульфата безопасно и сокращает частоту желудочковых аритмий [Браунвальд E., 1995; Knobel E., 1999].
Новый метод антиаритмической защиты миокарда при инфаркте миокарда — внутривенное лазерное облучение крови гелий-неоновым лазером. Его применяют в остром периоде заболевания. Лазерное облучение крови создает анальгети-ческий эффект, уменьшает число желудочковых экстрасистол более чем на 90 % и приводит к быстрой положительной динамике на ЭКГ [Быстрое В.И., Бутров А.В. и др., 1995].
Аритмии, наиболее опасные для жизни больного. Желудочковая тахикардия (рис. 24.1), которая может перейти в ФЖ. При длительной ЖТ применяют препараты, дающие
мембранный эффект. Препаратом выбора является лидокаин с последующей его комбинацией с пропра-нололом или проксинамидом. Если аритмия сохраняется и имеются нарушения гемодинамики, то проводят электроимпульсную терапию (дефибрилляцию).
Фибрилляция (мерцание) желудочков (рис. 24.2). Для прекращения фибрилляции проводят немедленную электродефибрилляцию. Для обеспечения хорошей оксигенации и перфузии миокарда необходима адекватная вентиляция кислородом. Кардиоверсию проводят постоянным током, начиная с 50 Дж, при отсутствии эффекта увеличивают разряд каждый раз на 50 Дж.
Желудочковые экстрасистолии могут угрожать жизни больного, так как способны переходить в мерцание и трепетание желудочков. Существует большая опасность развития ЖТ и ФЖ при выявлении одного или нескольких критериев:
1) частота желудочковых экстрасистол 6 и более в 1 мин (рис. 24.3);
2) политопные экстрасистолы (рис. 24.4);
3) групповые желудочковые экстрасистолы (рис. 24.5; 24.6; 24.7);
4) ранние желудочковые экстрасистолы типа «R» на «Т» (рис. 24.8).
Внутривенное введение лидокаина является методом выбора при желудочковых экстрасистолиях и аритмиях. Препарат начинает действовать быстро, и так же быстро исчезают его эффекты (в течение 15—20 мин после введения). Для быстрого достижения эффекта препарат вводят внутривенно болюсно из расчета 1 мг/кг. Для поддержания эффекта проводят постоянную инфузию лидокаина из расчета 2—4 мг/мин. Если аритмия сохраняется, то через 10 мин после введения первого болюса вводят второй в дозе 0,5 мг/кг. При застойной сердечной недостаточности дозу лидокаина уменьшают вдвое. Эффект наступает через 72—96 ч. Общая доза лидокаина до
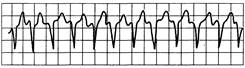
Рис. 24.1. Желудочковая тахикардия.
Зубцы P не выявляются, комплексы QRS имеют патологическую форму.
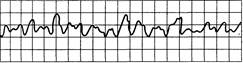
Рис. 24.2. Мерцание (фибрилляция) желудочков. Синусоида нерегулярная, неритмичная, комплексы QRST отсутствуют, частота волн мерцания более 250 в
минуту.
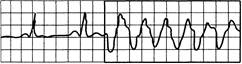
Рис. 24.3. Три и более (обычно до 9) последовательных желудочковых экстрасистол.
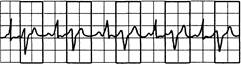
Рис. 24.4. Бигемения: каждый синусовый импульс сопровождается преждевременным желудочковым комплексом (экстрасистолой).
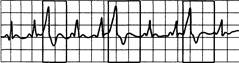
Рис. 24.5. Тригемения: за каждыми двумя синусовыми сокращениями следует экстрасистола.
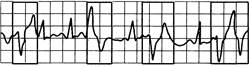
Рис. 24.6. Мультиформные желудочковые экстрасистолы. Морфологически различные преждевременные желудочковые комплексы (экстрасистолы).
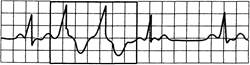
Рис. 24.7. Спаренные желудочковые экстрасистолы.
Две последовательные экстрасистолы за синусовым ритмом.
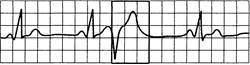
Рис. 24.8. Желудочковая экстрасистолия типа «R» на «Т».
Комплекс QRS экстрасистолы наслаивается на вершину или нисходящее колено предшествующего зубца T.
2000 мг/сут [Фрид M., Грайнс С., 1996; Marini JJ., Wheeler A.P., 1997]. Синусовая брадикардия. Мнения о значении брадикардии как фактора, предрасполагающего к развитию ФЖ, противоречивы. Синусовая брадикардия, возникающая в первые часы острого инфаркта миокарда, может привести в последующем в отличие от брадикардии, возникающей в более поздние сроки острого инфаркта миокарда, к появлению эктопических желудочковых ритмов. Лечение синусовой брадикардии показано в тех случаях, когда она вызывает нарушения гемо-динамики или когда на ее фоне развивается выраженная эктопическая
активность желудочков. Для ускорения синусового ритма используют атропин (внутривенно в дозе 0,4— 0,6 мг). Если пульс менее 60 в минуту, возможно повторное введение атропина по 0,2 мг до тех пор, пока общая доза не составит 2 мг. Но нужно помнить, что атропин может усугублять ишемию или вызывать ЖТ или ФЖ. При стойкой бради-кардии (менее 40 в минуту), латентной к введению атропина, требуется проведение электрической стимуляции сердца. Временная терапия чрескожной или чреспищеводной кардиостимуляцией, инфузией до-памина или эпинефрина может быть необходима при слишком медленном сердечном ритме для поддержания адекватного CB. Наиболее эффективна у таких больных трансвенозная электрокардиостиму-ляция.
Нарушения проводимости встречаются при инфаркте миокарда довольно часто, особенно в 1—2-й день болезни. Они могут возникать на различных уровнях проводящей системы сердца: в области предсердно-желудочкового узла, предсердно-же-лудочкового пучка (пучок Гиса) или в более дистальных отделах проводящей системы. Ишемия предсердно-желудочкового узла обычно встречается при инфаркте миокарда правого желудочка, потому что данный узел кровоснабжается правой коронарной артерией. Это может привести к атриовентрикулярной блокаде разной степени, вплоть до полной, ре-зистентной к атропину. В подобной ситуации необходима последовательная атриовентрикулярная электростимуляция, в то время как электростимуляции желудочка следует избегать из-за отсутствия эффекта и возможного вреда.
Наиболее опасные нарушения проводимости сердца:
• блокада сердца II степени (промежуточная атриовентрикулярная блокада) возникает в том случае,
когда часть импульсов не достигает желудочков. АВ-блокада типа Мобиц-I (АВ-блокада Венкебаха) (рис. 24.9) является следствием нарушения проводимости на уровне предсердно-желудочкового узла. В редких случаях блокада Mo-биц-I может прогрессировать до полной блокады сердца. АВ-блокада типа Мобиц-П (рис. 24.10) имеет тенденцию к прогрессиро-ванию вплоть до полной блокады сердца. Подчиненный водитель ритма, включающийся в нижних отделах системы Гиса—Пуркинье вследствие ускользания, обладает нестабильным, медленным ритмом. Прогноз часто неблагоприятный. В этом случае показана имплантация кардиостимулятора;
• АВ-блокадп III степени (рис. 24.11) происходит в случаях, когда ни один предсердный импульс не поступает к желудочкам. Полная АВ-блокада представляет значительную опасность для жизни больного. Клинически может проявляться аритмогенным шоком или приступами Морганьи— Адамса—Стокса, одним из проявлений которого является потеря сознания. Приступы чаще всего возникают в результате длинной предавтоматической паузы при переходе от неполной АВ-блока-ды к полной. Происходит резкое замедление деятельности сердца до полной его остановки, наступает гипоксия мозга или появляются групповые политопные экстрасистолы с переходом в трепетание и мерцание желудочков. При АВ-блокаде III степени наиболее эффективна трансвенозная эл ектрокардиостимуляция;
• пароксизмальная и предсердная тахикардия, трепетание и мерцание предсердий (рис. 24.12) при инфаркте миокарда встречаются редко. При мерцании (фибрилля-ции) предсердий могут возникать заметные расстройства гемодина-мики, обмороки, сердечная недо-
статочность. При нестабильной гемодинамике показано устранение мерцания и трепетания предсердий срочной кардиоверсией или электростимуляцией предсердий с частотой, превышающей частоту трепетания предсердий. Кардиоверсию проводят одиночным импульсом постоянного тока (заряд 200 Дж или менее).
Лечение. Цель лечения — поддержание CB на уровне, обеспечивающем основные потребности организма, и снижение риска потерь ишеми-зированного миокарда.
Условно лечение КШ можно разделить на:
• основные поддерживающие мероприятия (обезболивание; искусственная оксигенация и/или вентиляция; седатация; устранение аритмий, метаболического ацидоза и/или гиповолемии);
t фармакотерапию (инотропные и вазопрессорные средства, вазоди-лататоры, диуретики, ацетилса-лициловая кислота, гепариниза-ция);
• механическую поддержку кровообращения (электрокардиостиму-ляция, внутриаортальная баллонная контрпульсация, при неэффективности последнего — вспомогательные устройства, замещающие сниженную функцию желудочка — центробежные насосы, искусственное кровообращение и искусственные желудочки);
• реперфузию коронарных артерий (тромболизис, механическая ре-перфузия — чрескожная транслю-минальная коронарная ангио-пластика);
• оперативные вмешательства (хирургическая реваскуляризация миокарда).
Несмотря на такие значительные достижения в лечении заболеваний сердца, как тромболитическая терапия, методы частичного или полного искусственного кровообращения и
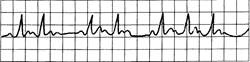
Рис. 24.9. АВ-блокада II степени (Вен-кебаха, Мобиц-1).
Постоянное удлинение интервала P-Q с выпадением комплекса QRST, интервалы R-R прогрессивно укорачиваются; P-P относительно постоянны.
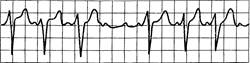
Рис. 24.10. АВ-блокада II степени (Мобиц-П). Интервалы P-Q постоянные, могут быть удлиненными; выпадение желудочковых комплексов QRST, длинные паузы равны удвоенному интервалу P-P; P. QRS= 3:2; 4:3; 5:4 и т.д.
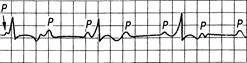
Рис. 24.11. АВ-блокада III степени (полная).
Интервалы R-R и P-P постоянные. Частота P больше частоты комплексов QRS; комплексы QRS нормальной продолжительности или расширены и деформированы.
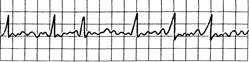
Рис. 24.12. Мерцание (фибрилляция) предсердий. Отсутствие четких зубцов P9 комплексы QRS неправильной формы, частоты и вольтажа. Частота сокращения предсердий около 350 и более в минуту.
трансплантация сердца, летальность при КШ остается очень высокой — от 30 до 90 % [Knobel E., 1999].
Глава 25 Гиповолемический шок
Среди различных типов шока чаще встречается гиповолемический шок (ГШ). Основу гемодинамичес-ких нарушений при этой форме шока составляют неадекватный ОЦК, уменьшение венозного возврата и снижение MOC.
Гиповолемический шок характеризуется критическим уменьшением тканевой перфузии, вызванной острым дефицитом циркулирующей крови, уменьшением венозного притока к сердцу и вторичным снижением CB. Основные причины, вызывающие снижение ОЦК, — кровотечение, потеря плазматической жидкости и обезвоживание.
Среди причин ГШ роль плазмо- и кровопотери при травмах, операциях и ожогах в его развитии выявляется достаточно легко. Труднее диагностируются скрытые источники плазмо- и кровопотерь: кишечные кровотечения, скопление жидкости в брюшной полости и просвете кишечника при перитоните, кишечной непроходимости и панкреатите, секвестрации крови в местах переломов, травматических повреждений мягких тканей и т.д.
Патофизиологические изменения. Большая часть последовательных повреждений при ГШ связана со снижением эффективности перфузии, что ухудшает транспорт кислорода, питание тканей и приводит к тяжелым метаболическим нарушениям. В развитии ГШ выделяют следующие фазы:
• дефицит ОЦК;
• стимуляцию симпатико-адрена-ловой системы;
• шок.
I φ а з а — дефицит ОЦК. Острый дефицит объема крови приводит к уменьшению венозного при-
тока к сердцу, снижению ЦВД и ДЗЛА. В результате этого снижается УО сердца. В пределах 1 ч интерсти-циальная жидкость устремляется в капилляры, соответственно снижается объем интерстициального водного сектора. Это перемещение происходит в течение 36—40 ч от момента кровопотери. Общий объем транскапиллярного наполнения возрастает максимум на 1 л.
II φ а з а — стимуляция симпа-тико-адреналовой системы. Рефлекторная стимуляция барорецепторов вызывает активизацию симпатико-адреналовой системы. Возбуждение ее ведет к повышению секреции ка-техоламинов, содержание которых возрастает в десятки (норадрена-лин) и сотни (адреналин) раз. Увеличивается симпатический тонус сердца, вен и артериол, уменьшается вагусное влияние на сердце. Стимуляция β-адренергических рецепторов приводит к увеличению сократительной способности миокарда и увеличению ЧСС. Стимуляция α-адренергических рецепторов вызывает сокращение селезенки, венозных сосудов, вазоконстрикцию в коже, скелетных мышцах, почках, приводя к повышению ОПСС и централизации кровообращения. Этот механизм направлен на поддержание MOC, АД, ЦВД, кровообращения в мозге и сердце за счет ухудшения кровообращения в органах, иннервируемых блуждающим нервом (печень, поджелудочная железа, кишечник), а также в почках, коже и мышечной системе. Вазо-констрикция объемных сосудов, вызывающая уменьшение емкости венозных сосудов, ведет к диспропорции между объемом крови и емкостью сосудистого русла. В коротком интервале времени эта реакция является защитной, и при быстрой нормализации объема крови наступает выздоровление. Если же дефи-
цит ОЦК сохраняется, то на первый план выступают отрицательные последствия длительной ишемии, за счет которых достигается централизация кровообращения.
Активация ренин-ангиотензин-альдостероновой системы вызывает задержку натрия, содержащегося преимущественно в интерстициаль-ном водном секторе. Этот механизм способствует задержке жидкости и восполнению объема последнего.
III φ а з а — гиповолемический шок. Дефицит объема крови, уменьшение венозного возврата, давления наполнения сердца, MOC, АД и тканевой перфузии на фоне продолжающейся адренергической реакции являются основными звеньями ГШ.
Гемодинамика. В результате сим-патоадренергической реакции происходит сужение сосудов, особенно артерий. Депо крови опустошаются, сила и частота сердечных сокращений повышаются, происходит мобилизация крови из легких, открываются артериовенозные шунты. Объем внутрисосудистого водного сектора частично увеличивается вследствие притока интерстициаль-ной жидкости. Благодаря этому на первом этапе ГШ может наблюдаться гипердинамическая реакция кровообращения, обусловленная снижением доставки кислорода к тканям. Начинающийся шок, характеризующийся нормальным АД, тахикардией и холодными кожными покровами, называют фазой I, или компенсированным шоком [Хартиг В., 1982].
При продолжающемся кровотечении снижается не только УО, но и MOC. Одновременно со снижением CB возрастает ОПСС. Вазокон-стрикция пре- и посткапиллярных сосудов приводит к снижению капиллярного кровотока. С прогрес-сированием шока накопление кислых продуктов метаболизма сопровождается расширением прекапил-лярных сфинктеров, в то время как посткапиллярные сфинктеры остаются суженными (большая часть
крови депонируется в капиллярах). Феномен централизации кровообращения сопровождается полиорганной недостаточностью.
Снижение кровотока, ведущее к ишемии органов и тканей, происходит в определенной последовательности: кожа, скелетные мышцы, конечности, почки, органы брюшной полости, легкие, сердце, мозг.
При продолжающейся кровопоте-ре АД становится ниже 100 мм рт.ст., а пульс 100 или более в минуту. Отношение ЧСС/АДСИСт — индекс шока (ИШ) — выше 1. Это состояние (холодная кожа, гипотен-зия, тахикардия) определяется как фаза II, или декомпенсированный шок (табл. 25.1).
Таблица 25.1. Гемодинамика при гиповолемическом шоке
| Показатели | Компенсированный шок | Декомпенсированный шок |
| АДСИСТ | >100 мм рт.ст. | <100 мм рт.ст. |
| чсс | < 100— ПО уд/мин | >110 уд/мин |
| СИ | >3,5 л/(мин-м2) | <2,5 л/(мин-м2) |
| ЦВД | Снижено | Снижено |
| ОПСС | >1 200-2500 дин/с-см5-м2 | >2500 дин/с-см5-м2 |
| ИШ | <1 | >1 |
Реологические нарушения. Секвестрация крови и замедление капиллярного кровотока приводят к спонтанному свертыванию крови в капиллярах. Типичными клеточными агрегантами являются скопления эритроцитов и тромбоцитов. Стаз крови и выход из поврежденных клеток субстанций, активирующих свертывание, способствуют возникновению коагулопатии потребления, т.е. расходу определенных компонентов свертывания: тромбоцитов, фибриногена, протромбина и диссеминированному внутрисосу-дистому свертыванию.
Транспорт кислорода. При ГШ стимулируется анаэробный метаболизм,
Таблица 25.2. Доставка кислорода к тканям в зависимости от степени кровопоте-ри и гемодинамической компенсации
| Показатель | Компенсация (п = 30) | Субкомпенсация (п = 34) | Декомпенсация (п= 11) | Шок |
| Степень кровопотери | ||||
| Дефицит ГО, % | <30 | <40 | >50 | |
| Дефицит ОЦК, % | <10 | <25 | >30 | |
| Состояние гемодинамики | ||||
| СИ, л/мин-м2 | 2,9-4,6 | 4,1-5,3 | 5,4-7,8 | 1,5-2,8 |
| РЛЖ, кг-м/мин | 6,8-9,3 | 10,4-13,2 | 8,8-10,5 | 2,4-3,8 |
| Состояние транспорта кислорода | ||||
| ИКП, мл/мин-м2 | 540-660 | 550-670 | 400-475 | 230-137 |
| ЭКТК, кг-м/100 мл O2 | 1,1-1,5 | 1,6-2,3 | 2,0-2,4 | 1,4-2,3 |
Примечание. ЭКТК — энергокоэффициент транспорта кислорода.
приводящий к ацидозу. Дефицит глобулярного объема (ГО) сопровождается соответственным снижением содержания кислорода в крови (CaOi). При относительно умеренной кровопотере доставка кислорода к тканям (DO2) поддерживается гипердинамическим режимом кровообращения. Снижение CB при значительной кровопотере и шоке ведет к резкому уменьшению DO2.
Динамика доставки кислорода к тканям. В табл. 25.2 представлены данные об изменениях DO2 в зависимости от степени кровопотери и компенсаторной реакции кровообращения. При кровопотере до 10 % ОЦК и 30 % глобулярного объема (ГО) СИ колеблется в нормальных пределах и DO2 не нарушена. При кровопотере до 25 % и дефиците ГО до 40 % СИ возрастает до 5,3 л/мин-м2, работа левого желудочка (РЛЖ) увеличивается. до 13,2 кг/мин, благодаря чему DO2 фактически не нарушается. Снижение DO2 до 400—475 мл/мин-м2 наступает при значительной кровопотере — более 30 % ОЦК и дефиците ГО более 50 %. При шоке наблюдается гиподинамический режим кровообращения, СИ и работа лево-
го желудочка снижены до критического уровня. Индекс доставки кислорода (ИКП) снижен до 230— 137 мл/мин-м2, т.е. в 3—4 раза по сравнению с нормой (520— 720 мл/мин-м2).
, Потребление кислорода тканями (VO2) не соответствует их потребностям для аэробного метаболизма. Потребление кислорода, сниженное во время шока, закономерно возрастает при успешном лечении в постшоковом периоде. При этом сверхнормальные значения VO2 отражают нормальную физиологическую реакцию, направленную на ликвидацию кислородной задолженности тканям [Марино П., 1998].
Транспорт кислорода при гипово-лемическом шоке:
• SaO2 и PaO2 снижены в результате нарушений вентиляционно-пер-фузионных соотношений в легких;
• CaO2 снижено в результате уменьшения ГО, снижения SaO2 и PaO2;
• DO2 снижается с момента перехода гипердинамического состояния кровообращения в нормо-или гиподинамический тип;
• VO2, как правило, снижено;
• уровень лактата крови повышен.
Длительная ишемия ренальной и чревной областей сопровождается недостаточностью функций почек и кишечника. Мочевыделительная и концентрационная функции почек снижаются, но при своевременном лечении это состояние может быть обратимым. При длительной ишемии почки полностью утрачивают гомеостатические функции.
При длительной ишемии развиваются некрозы в слизистой оболочке кишечника, печени, почках и поджелудочной железе. Нарушается барьерная функция кишечника. Бактериальные токсины, гистамин и метаболиты поступают в кровоток. Эти вещества могут активизировать кининовую систему и угнетать функцию миокарда. Процесс в легких развивается по типу РДСВ. Снижение мозгового кровотока сопровождается нарушениями функций ЦП С вплоть до комы.
Полиорганная недостаточность при ГШ:
• почки — олигурия -> анурия;
• кишечник — паралитический илеус, образование острых язв, нарушение барьерной функции, выход токсинов в кровь;
• печень — некрозы, снижение функции;
• сердце — нарушение механизма Франка—Старлинга, снижение сократительной способности миокарда;
• легкие — нарушения вентиляци-онно-перфузионных отношений, развитие РДСВ;
• мозг — затемнение сознания, кома.
Клинические критерии шока:
• частый малый пульс;
• снижение систолического АД;
• снижение ЦВД;
• холодная, влажная, бледно-цианотичная или мраморная кожа;
• замедленный кровоток в ногтевом ложе;
• температурный градиент более 3°С;
• олигурия.
Эти симптомы соответствуют декомпенсации кровообращения и являются показанием к немедленной противошоковой терапии. АД может оставаться достаточно долго нормальным, например при медленном снижении ОЦК. Вазоконстрик-ция кожных покровов обычно протекает без видимого цианоза.
CB не может быть показателем адекватности перфузии тканей. Выраженная вазоконстрикция нарушает распределение кровотока: большая часть органов и тканей страдает от дефицита перфузии при относительно нормальной работе сердца как насоса. Определение фактического MOC на этапах ИТ — достаточно точный показатель кровообращения.
ЦВД может быть повышенным при сердечной недостаточности и ИВЛ, особенно в режиме ПДКВ. Это ни в коей мере не умаляет важности определения ЦВД как важнейшего критерия ГШ.
Сложность патогенеза исключает существование какого-то одного показателя, отражающего всю гамму изменений при шоке, например в критериях транспорта кислорода. На суммарной оценке транспорта кислорода сказываются собственно перфузия тканей, зависящая от системы кровообращения, и состояние окислительного метаболизма, т.е. то конечное звено, которое определяет тяжесть последствий неадекватной тканевой перфузии.
Клиническая картина в большой степени зависит от объема потерянной крови, скорости кровопотери и компенсаторных механизмов организма. Имеют значение и другие факторы: возраст, конституция, сопутствующие заболевания сердца, легких.
Важнейшие критерии шока: частота пульса, АД, индекс Аллгове-ра, ЦВД, клинические симптомы нарушений гемодинамики и функции органов.
Для определения зависимости шока от кровопотери удобно пользоваться 4-степенной классификацией (американская коллегия хирургов):
| Степень | Потеря ОЦК, % |
| I | 15 и менее |
| II | 20-25 |
| III | 30-40 |
| IV | Более 40 |
Потеря 15 % ОЦК. Клинические признаки кровопотери могут отсутствовать. У больного, находящегося в горизонтальном положении, нет симптомов кровопотери. Единственным признаком может быть увеличение частоты пульса не менее чем на 20 в минуту, возникающее при вставании с постели.
Потеря от 20 до 25 % ОЦК. Основной симптом — ортостатическая гипотензия — снижение систолического АД не менее чем на 15 мм рт.ст. В положении лежа АД обычно сохранено, но может быть несколько снижено [Марино П., 1998]. Это состояние при продолжающемся кровотечении может быстро перейти в следующую фазу. Систолическое АД более 100 мм рт.ст., частота пульса 100—110 в минуту, индекс шока не более 1 [Хартиг В., 1982].
Потеря от 30 до 40 % ОЦК. Клиническая картина соответствует умеренному или компенсированному шоку: холодные кожные покровы, симптом «бледного пятна», частота пульса более 100 в минуту, артериальная гипотензия в положении лежа на спине, олигурия. Критическими являются падение систолического АД ниже 100 мм рт.ст. и учащение пульса более 100 в минуту. Индекс шока > 1.
Потеря более 40 % ОЦК. Клиническая картина соответствует тяжелому или декомпенсированному шоку: холодные кожные покровы, резкая бледность, мраморность кожи, нарушение сознания вплоть до комы, отсутствие пульса на периферических артериях, падение АД, CB. Индекс шока>1,5. Анурия.
Il Потеря более 40 % ОЦК потен- Il циально опасна для жизни.
Лечение. Главнейшее звено, которое должно восстанавливаться при ГШ в первую очередь, —транспорт кислорода. Нарушения транспорта кислорода при ГШ зависят от:
• недостаточного венозного притока к сердцу, связанного с ним низкого CB и гиподинамического состояния кровообращения;
• низкого содержания кислорода в артериальной крови в связи с потерей гемоглобина.
Важную роль играет дефицит ин-терстициальной жидкости, нарушающий транскапиллярный обмен жидкости и кислорода.
Программа интенсивного лечения ГШ:
• быстрое восстановление внутри-сосудистого объема;
• улучшение функции сердечно-сосудистой системы;
• восстановление объема циркулирующих эритроцитов;
• коррекция жидкостных дефицитов;
• коррекция нарушенных систем гомеостаза.
Из всех имеющихся в настоящее время средств для быстрого восстановления внутрисосудистого объема наиболее эффективными являются гетерогенные коллоидные растворы: декстран и крахмал, обладающие выраженным гемодинамическим про-тивошоковым действием. Коллоидные растворы значительно быстрее,
чем кристаллоидные, восстанавливают объем циркулирующей плазмы и таким образом обеспечивают достаточный приток крови к сердцу. Доказано, что CB повышается быстрее в тех случаях, когда первично проводится инфузия коллоидных растворов, обладающих объемозамещаю-щим и реологическим действием. По сравнению с цельной кровью и эрит-роцитной массой в первичном возмещении объема эти препараты имеют несомненное преимущество [Марино П., 1998].
Даже при сниженном содержании кислорода в артериальной крови возросший CB может обеспечить адекватную доставку кислорода к тканям. При первичном возмещении коллоидные растворы комбинируют с электролитными инфузи-онными растворами, содержащими Na+ и СГ. Электролитные растворы (раствор Рингера, 0,9 % раствор натрия хлорида) необходимы для коррекции интерстициального объема. Скорость инфузии плазмозамещаю-щих и электролитных растворов определяется состоянием больного. При тяжелом шоке показано струйное введение растворов.
Показания к гемотрансфузии должны быть очень строгими. Это особенно важно в свете последних данных об иммунодепрессивных состояниях. Несмотря на все имеющиеся ограничения к гемотрансфузии, показанием к ее назначению служит значительное уменьшение уровня гемоглобина. Ориентировочно этот уровень может быть равен 80 г/л, но до недавнего времени показанием к гемотрансфузии считалось снижение уровня гемоглобина крови ниже 100 г/л. Не оспаривая в целом эти положения, заметим, что наиболее достоверным обоснованием тактики является показатель транспорта кислорода, особенно его потребление тканями. Полагаем, что старое правило: чем больше кровопотеря, тем больше показаний к гемотрансфузии — пока еще оста-
ется в силе. Не вызывает сомнений, что кровопотеря, равная 50 % ОЦК, требует обязательного возмещения части этой кровопотери препаратами крови — эритроцитной массой или цельной кровью. При этом не следует ограничиваться гетерогенными плазмозамещаюшими растворами, а использовать плазму или растворы альбумина.
Критерии инфузионной терапии:
А восстановление адекватного CB: СИ 2,5—3,5 л/мин-м2 или выше; АДсист не ниже 100 мм рт.ст.; ЧСС 100 в минуту или менее; ДНЛЖ 12-16 мм рт.ст.; ОПСС 1200-2500 дин/с-см5-м2.
При продолжающейся сердечной недостаточности, не связанной с дефицитом сосудистого объема, показаны симпатомиметические средства — добутамин или допамин. Наиболее приемлемый метод оценки показателей ЦГ — бескровный динамический контроль (мониторинг аппаратом «Реодин»);
А динамический контроль (мониторинг жидкостного распределения в водных секторах — сосудистом, интерстициальном и клеточном) осуществляется путем бескровного метода по принципу Томассе-та. Работа монитора трансфузио-лога основана на принципе импе-дансометрии зондирующими токами определенной частоты. Сопротивление тканей измеряется в зависимости от их наполнения жидкостью. Этот метод позволяет определять объемы общей, вне- и внутриклеточной, интерстициаль-ной и сосудистой жидкости в сравнении с должной величиной и представить в виде таблицы, трен-да или диаграммы [Малышев В.Д. и др., 1998];
А почасовой диурез должен составлять 40—50 мл/ч. На фоне достаточного жидкостного восполнения для стимуляции диуреза могут быть
использованы фуросемид (20— 40 мг и более) или допамин в малых дозах (3—5 мкг/кг/мин), улучшающий ренальное кровообращение и способствующий профилактике почечной недостаточности;
А динамический контроль газов крови и КОС. Эти показатели необходимы для расчетов транспорта кислорода на всех.этапах лечения. В норме индекс DO2 равен 520— 720 мл/(мин-м2). Для измерения потребления кислорода тканями необходимо знать содержание кислорода не только в артериальной, но и в смешанной венозной крови (CvO2). Увеличение дефицита оснований может указывать на избыток молочной кислоты, являющейся показателем анаэробного обмена;
А прочие показатели гомеостаза. Важно поддерживать КОД плазмы крови на уровне 20—25 мм рт.ст., осмолярность плазмы в диапазоне 280—300 мосм/л, уровень альбуминов и общего белка 37—50 г/л, глюкозы 4—5 ммоль/л, степень гемодилюции 27—35 %, контролировать состояние свертывающей и противосвертывающей систем крови [Малышев В.Д., 2000].
Первичное возмещение кровопоте-
ри. Необходимые расчеты. У взрослого мужчины ОЦК определяют по формуле: 70 χ масса тела (кг); у женщин: 65 χ масса тела (кг). Таким образом, у мужчины с массой тела 70 кг ОЦК будет равен:
70 χ 70 - 4900 мл (5000 мл); 20% ОЦК = (5000x20): 100 - 1000 мл; 30% ОЦК = (5000x30): 100 = 1500 мл; 50% ОЦК = (5000x50): 100 = 2500 мл.
У тучных и пожилых людей ОЦК примерно на 5 мл/кг ниже указанных величин. ОЦК у лиц атлетического телосложения примерно на 5 мл/кг выше средней нормы. В схеме 25.1 приведены алгоритмы возмещения кровопотери.
Схема 25.1
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 841; Нарушение авторских прав?; Мы поможем в написании вашей работы!