
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок рeакции
|
|
|
|
От чего зависит скорость реакции
Интуитивно, каждый понимает, что число молекул, которые вступят в реакцию за единицу времени, зависит от ряда обстоятельств:
- от концентрации реагирующих молекул, т.е. от концентрации первого субстрата реакции; в нашем случае это концентрация ионов Fe2+.
- от вероятности встретить другую молекулу, которая пропорциональна числу молекул в единице объёма, а следовательно пропорциональна молярной концентрации второго субстрата реакции; в нашем случае это величина [HOOH].
- от вероятности того, что столкнувшиеся молекулы прореагируют. Обозначим её через р.
Таким образом, скорость реакции в нашем случае будет равна:
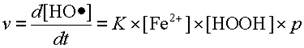
| (1) |
,
где K - коэффициент пропорциональности. Произведение констант K ´ p в свою очередь является некоторой постоянной и называется константой скорости реакции. Обозначим её через k.
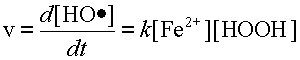
| (2) |
Поскольку скорость реакции взаимодействия двух веществ пропорциональна произведению концентраций этих двух субстратов, такого типа реакции называются реакциями второго порядка.
Если бы для реакции требовалось одновременное участие трёх субстратов, то скорость её должна была бы зависеть от произведения концентраций всех трёх веществ, и мы бы имели реакцию третьего порядка. Этого однако практически не бывает, поскольку в подобных ситуациях сначала обычно реагируют две молекулы. а уж потом в дело вступает третья.
Известны реакции, где имеется всего один субстрат; сюда относятся реакции распада или изомеризации веществ. В этом случае скорость реакции пропорциональна концентрации этого одного субстрата. Такие реакции называются реакциями первого порядка. Скорость реакции первого порядка A ® B равна:
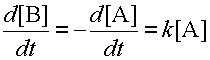
| (3) |
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 344; Нарушение авторских прав?; Мы поможем в написании вашей работы!