
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые реакции
|
|
|
|
Предположим, вещество A может превращаться в вещество B, а оно, в свою очередь, обратно переходит в вещество A. Изменение концентрации вещества A обусловлено одновременным протеканием двух реакций: распада A со скоростью k 1[A] и его образования со скоростью k 2[B]. Скорость изменения концентрации вещества A равна разности этих величин:
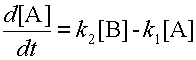
| (8) |
Надо сказать, что чем сложнее схема реакции, тем сложнее соответствующая система уравнений, и преобразования могут стать довольно громоздкими. Поэтому в дальнейшем мы наряду с распространенным обозначением концентрации будем использовать переменные в виде малых латинских букв, т.е. a вместо [A], b вместо [B] и т
Концентрацию b находим из уравнения 6 материального баланса и подставляем в уравнение 8.
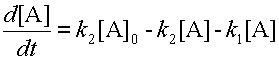
| (9) |
или, используя новые, более компактные обозначения:

| (10) |
Произведём разделение переменных:
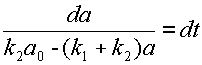
| (10) |
и интегрирование в пределах от ao до a и от 0 до t:
 
| (11) |
После преобразований получаем весьма громоздкое выражение для значения концентрации субстрата:
 откуда
откуда 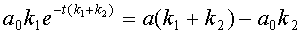

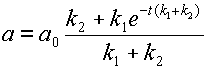 (12)
(12)
Это выражение можно несколько упростить, если ввести понятие равновесной концентрации вещества A:  при
при 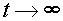 .
.
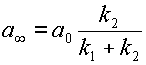
| (13) |
Из уравнения 12 получаем,

| (14) |
Что вместе с 12 дает:
С другой стророны, из уравнения 13 находим

| (15) |
Разделив уравнение 14 на 15, получаем очень интересное выражение:
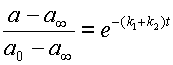
| (16) |
Откуда
На рис. 2 приведены кривые кинетики (изменения во времени концентраций) для веществ A и B в случае обратимого процесса. Анализ этих кривых, если они получены экспериментально, сразу позволяет найти отношение констант скоростей k1 / k2. Чтобы определить сами скорости, необходимо построить график в виде линейной анаморфозы (см. ниже).
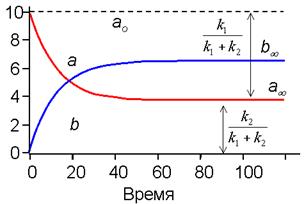
| Рис. 2. Кинетика обратимой мономолекулярной реакции По отношению отрезков ординат для a при достижении равновесия (a¥) находим соотношение констант прямой и обратной реакции. (см. уравнение 16) |
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 489; Нарушение авторских прав?; Мы поможем в написании вашей работы!