
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Білет №7
|
|
|
|
1. Кофактори та коферменти. Будова та властивості коферментів, вітаміни як попередники в біосинтезі коферментів.
Кофактори та коферменти Кофактори. Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних
низькомолекулярних небілкових сполук кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природи
або іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cuj+ та ін.). Іони металів зв'язані з апоферментом або входять до складу небілкової
простетичної групи - найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно
зв'язані з іонами металів і не втрачають цього зв'язку за умов виділення та фракціонування ферменту, назваються металоферментами. У
деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх
активаторів. Коферменти (коензими) — біоорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто
перетворення субстрату в каталітичному акті. Коферменти можуть сполучатися з білковою частиною (апоферментом) нековалентними
фізико-хімічними або ковалентними зв'язками (в останньому випадку вони є простетичними групами ферментного білка - флавінові
коферменти, піридоксаль-фосфат, ліпоєва кислота тощо); інколи коферменти утворюють комплекси з апоферментом лише в ході
каталітичного процесу (НАД, НАДФ). За хімічною природою коферменти підрозділяють на: - похідні вітамінів, зокрема: вітаміну В, -
тіаміндифосфат; вітаміну В2 - флавінмононуклеотид (ФМН); вітаміну В6 - піридоксальфосфат, піридоксамінфосфат; пантотенової
кислоти - коензим А; вітаміну В12 - метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) - карбоксибіотин; фолієвої
кислоти - тетрагідрофолієва кислота; - динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД); - нуклеотиди -
похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ); - комплекси порфіринів з іонами металів.__
2. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
Ферментативні реакції синтезу глікогену
1) Утворення нуклеотидцукру-попередника
Усі біохімічні реакції утворення складних вуглеводів – оліго-та полісахаридів потребують наявності метаболічно активних форм
моносахаридів,у ролі яких виступають сполучені з цукрами нуклеотиди.Метаболічно активною формою глюкози,що використовується
у формуванні нерозгалужених гомополісахаридних ланцюгів глікогену,є УДФ-1-глюкоза.
Реакція каталізується УДФ-глюкозопірофосфорилазою
2) Формування нерозгалужених ланцюгів глікогену
Фермент- УДФ-глікогентрансфераза
3) Формування розгалужень у молекулі глікогену
Розгалуження в молекулі глікогену виникають за рахунок внутрішньомолекулярного переносу олігосахаридного фрагмента з 6-7
мономерів із кінця до С-6 гідроксильну групу глюкози.
Фізіол.значення глікогену
Глікоген є резервною формою глюкози,збереження надлишків якої у вигляді молекул мономерів неможливе у зв*язку з ії високою
осмотичною активністю.
Білет 7
1)Кофактори та коферменти
Кофактори. Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних низькомолекулярних небілкових сполук кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природи або іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cuj+ та ін.). Іони металів зв'язані з апоферментом або входять до складу небілкової простетичної групи - найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно зв'язані з іонами металів і не втрачають цього зв'язку за умов виділення та фракціонування ферменту, назваються металоферментами. У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів. Коферменти (коензими) — біоорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті. Коферменти можуть сполучатися з білковою частиною (апоферментом) нековалентними фізико-хімічними або ковалентними зв'язками (в останньому випадку вони є простетичними групами ферментного білка - флавінові коферменти, піридоксаль-фосфат, ліпоєва кислота тощо); інколи коферменти утворюють комплекси з апоферментом лише в ході каталітичного процесу (НАД, НАДФ). За хімічною природою коферменти підрозділяють на: - похідні вітамінів, зокрема: вітаміну В, - тіаміндифосфат; вітаміну В2 - флавінмононуклеотид (ФМН); вітаміну В6 - піридоксальфосфат, піридоксамінфосфат; пантотенової кислоти - коензим А; вітаміну В12 - метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) - карбоксибіотин; фолієвої кислоти - тетрагідрофолієва кислота; - динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД); - нуклеотиди - похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ); - комплекси порфіринів з іонами металів.

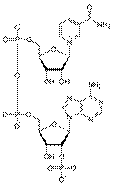
НАД НАДФ
2) молекулярна організація ланцюга переносу електронів
Основна роль монооксигеназного ланцюга полягає в гідрокси-люванні, тому флавопротеїни і цитохроми, які функціонують у цьому ланцюзі окислення, дуже відрізняються від ферментів дихального мітохондріального ланцюга.
Електрони НАДФ-Н, які мають високий енергетичний потенціал, переносяться на флавопротеїн цього ланцюга; потім вони передаються на адренодоксин (білок, який містить негемове залізо); останній переносить електрони на окислену форму цитохрому Р-450, після чого відновлена форма Р-450 активує кисень. Вважається, що цитохром Р-450 виконує подвійну функцію. По-перше, він зв'язує субстрат гідро-ксилювання, по-друге, - активує молекулярний кисень з утворенням радикалів *ОН, НО2* та ін. При цьому активований кисень використовується для окислення речовини (Я) та утворення води. Як результат один атом кисню включається в речовину (ЯОН), що окислюється, а інший, зв'язуючи два іони Н+ із середовища, входить до складу води. Велике значення має мікросомальне окислення у метаболізмі лікарських речовин і ряду токсичних сполук.
3)Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
Ферментативні реакції синтезу глікогену 1)Утворення нуклеотидцукру-попередника Усі біохімічні реакції утворення складних вуглеводів – оліго-та полісахаридів потребують наявності метаболічно активних форм моносахаридів,у ролі яких виступають сполучені з цукрами нуклеотиди.Метаболічно активною формою глюкози,що використовується у формуванні нерозгалужених гомополісахаридних ланцюгів глікогену,є УДФ-1-глюкоза. Реакція каталізується УДФ-глюкозопірофосфорилазою 2)Формування нерозгалужених ланцюгів глікогену Фермент- УДФ-глікогентрансфераза 3)Формування розгалужень у молекулі глікогену Розгалуження в молекулі глікогену виникають за рахунок внутрішньомолекулярного переносу олігосахаридного фрагмента з 6-7 мономерів із кінця до С-6 гідроксильну групу глюкози. Фізіол.значення глікогену Глікоген є резервною формою глюкози,збереження надлишків якої у вигляді молекул мономерів неможливе у зв*язку з ії високою осмотичною активністю.
 глікоген
глікоген
4)Катаболізм вищих жирних кислот, роль карнітину
Карнітин, який бере участь у перенесенні молекул ацил-КоА до мітохондріального магриксу.
Транспортна функція карнітину реалізується за човниковим принципом (рис. 14.4.): а) на зовнішній поверхні внутрішньої мітохондріальної мембрани за участю ферменту кариніти-ацилтрансферази І відбувається утворення ефіру ацилкарнітину: ацил-S-KoA + карнітин -ацилкарнітин + HS-KoA б) транспортний білок карнітин-ацилкарнітин-піранслоказа переносить ацилкарнітин через мембрану мітоходрій; в) на внутрішній поверхні мембрани фермент карнітин-ациятрансфераза II розщеплює ацилкарнітин у наступній реакції: ацилкарнітин + HS-KoА-------»ацил-S-KoA + карнітин Ацил-S-KoA вступає на шлях ß-окислення, а вільний карнітин виходить з мітохондрій і бере участь у транспортуванні нової молекули жирної кислоти.
Катаболізм жирних кислот відбувається в матриксі мітохондрій у результаті циклічного процесу який включає в себе послідовне відщеплення від довголанцюгових молекул насичених жирних кислот, що складаються з парної кількості вуглецевих атомів, двовуглецевих фрагментів циклу бета окислення.
Активація жирних кислот за участю ацил-КоА-синтетаз: R-COOH + KoA-SH + АТФ = R-CO-S-KoA + АМФ + ФФн
Ферментативні реакції бета-окислення жирних кислот. Окислення жирних кислот вклю-
чає 4 реакції.
1. Дегідрування жирної кислоти в бета-положенні за участю ФАД-залежної ацил-КоА-
дегідрогенази з утворенням еноїл-КоА (подвійний зв’язок має транс-конфігурацію).
R-СН2-СН2-CO~S-KoA + ФАД → R-СН=СН-CO~S-KoA + ФАДН2
2. Гідратація подвійного зв’язку за участю еноїл-КоА-гідратази
R-СН=СН-CO~S-KoA + Н2О → R-СНОН –СН2-CO~S-KoA
3. Повторне дегідрування за участю НАД-залежної 3-гідроксиацил-КоА-дегідрогенази
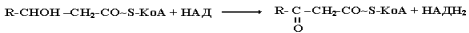
4. Тіолазна реакція, яка веде до вкорочення ланцюга жирної кислоти на 2 атоми карбону, які
вивільнюються у вигляді ацетил-КоА. Каталізується ацетил-КоА-ацилтрансферазою

Утворений в тіолазній реакції ацил-КоА здатний знову вступати в нові цикли бета-окислення,
які завершуються утворення бутирил-КоА, який далі розпадається на 2 молекули ацетил-
КоА. Для повного розщеплення молекули жирної кислоти з парним числом атомів карбону до
ацетил-КоА потрібно n/2-1 циклів бета-окислення. Ацетил-КоА може утилізуватись в циклі
трикарбонових кислот, чи піддаватись іншим перетворенням.
Сумарне рівняння бета-окислення пальмітинової кислоти виглядає так:
С15Н31-СО~S-KoA → 8 СН3-CO~S-KoA + 7ФАДН2 + 7НАДН2 (7 циклів бета-окислення)
Задача
До лікаря звернувся пацієнт зі скаргами на періодичні болісні судоми……..
Які лабораторні дослідження можуть підтвердити діагноз?
Основний метод: дослідження сироватки крові
Іноді використовують Ультразвукове дослідження паращитоподібної залози
Імунологічні тести:
· виявлення антитіл до тиреоїдних антигенів - до тиреоглобуліну та мікросомальних тиреоїдних фракцій. Титр сироваткових антитіл в міру прогресування захворювання зростає;
· зниження загальної кількості Т-лімфоцитів за рахунок Т-супресорів;
· збільшення коефіцієнта Т-хелпери/Т-супресори;
· збільшення концентрації в крові ІgG, М, особливо А;
· підвищення рівня циркулюючих імунних комплексів.
|
|
|
|
|
Дата добавления: 2015-05-07; Просмотров: 939; Нарушение авторских прав?; Мы поможем в написании вашей работы!