
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические основы синтеза аммиака
|
|
|
|
Реакция синтеза аммиака из АВС представляет гетерогенно-каталитическую обратимую экзотермическую реакцию, протекает с уменьшением объема, без образования каких-либо побочных продуктов и описывается уравнением:
N2+3H2=2NH3 - ∆H,
тепловой эффект реакции зависит от температуры и давления и составляет 111,6 кДж при температуре 5000С и давление 30 МПа.
Согласно принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно [∆S298= --198,13 кДж/(моль ∙ К)] и не благоприятствует протеканию реакции. При отрицательном значении ∆S повышение температуры уменьшает вероятность протекания реакции, так как ∆S определяет характер зависимости ∆G от температуры согласно уравнению
 |
Реакция синтеза аммиака протекает с уменьшением объема. Согласно уравнению реакции 4 моль исходных газообразных реагентов образуют уравнению реакции 4 моль исходных газообразных реагентов образуют 2 моль газообразного продукта. Основываясь на принципе Ле Шателье, можно сделать вывод о том, что в условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком.
|
 |
Использование константы равновесия позволяет количественно оценить степень предсказываемых изменений. Для реакции синтеза константа равновесия имеет вид:
|
 |
и может быть рассчитана по уравнению:
в котором (А,В,С-постоянные величины) коэффициенты а и β зависят от давления и возрастают с его увеличением. В условиях равновесия содержание аммиака в газовой смеси определяется из выражения:
 |
|
В табл. 6.4 приведено содержание аммиака в равновесной газовой смеси для различных температур при среднем 30 МПа и высоком 100 МПа давлениях, рассчитанное по формуле (6.7).
Таблица 6.4.
Содержание аммиака (об.долей) в газовой смеси
| Р, МПа | Температура, 0С | |||||
| 0,899 | 0,710 | 0,470 | 0,264 | 0,138 | 0,073 | |
| 0,983 | 0,925 | 0,800 | 0,575 | 0,314 | 0,128 |
Зависимость содержания аммиака в равновесной газовой смеси от температуры и давления представлена на рис. 6.5.
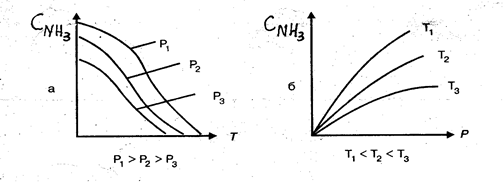 |
Рис. 6.5. Зависимость содержания аммиака в смеси от температуры (а) и давления(б)
Из табл. 6.4 и рис.6.5 следует, что повышение давления и снижение температуры смещает равновесие реакции синтеза и повышает равновесный выход аммиака.
Выход аммиака увеличивается с уменьшением температуры. Однако при этом падает скорость процесса катализа, а следовательно, и общая производительность цеха. Даже при сравнительно высоких температурах энергия активации молекул азота велика и процесс синтеза аммиака в гомогенной газовой фазе практически неосуществим. Для снижения энергии активации используются катализаторы, позволяющие значительно уменьшить температуру процесса.
Реакция синтеза аммиака катализируется металлами, имеющими не полностью застроенные d- и f- электронные уровни. К ним относятся железо, родий, вольфрам, рений, осмий, платина, уран и некоторые другие металлы. В промышленности используются контактные массы на основе железа, например, катализатор ГИАП состава:
 {Fe+Aℓ2O3+K2O+CaO+SiO2}.
{Fe+Aℓ2O3+K2O+CaO+SiO2}.
катализатор промотор
Он дешев, достаточно активен при температуре 450-500С, менее остальных катализаторов чувствителен к каталитическим ядам. Промоторы в составе контактной массы способствуют созданию высокоразвитой поверхности, препятствуют рекристаллизации катализатора и повышают его активность. Соединения серы отравляют катализатор необратимо, а кислород и некоторые его соединения, особенно СО,--обратимо, но очень быстро и даже в ничтожно малых концентрациях.
Механизм действия катализатора в процессе синтеза аммиака может быть представлен как ряд элементарных актов:
1) диффузия молекул азота и водорода из газового объема к поверхности зерна катализатора и в его парах;
2) активированная адсорбция азота на поверхности катализатора;
3) адсорбция водорода, обусловливающая поверхностную химическую реакцию между азотом и водородом через промежуточные соединения их с катализатором;
4) десорбция продукта;
5) диффузия продукта реакции (аммиака) от поверхности катализатора в газовую фазу.
Многочисленными исследованиями установлено, что лимитирующей стадией собственно катализа является хемсорбция азота.
В соответствии с представлениями электронной теории катализа водород передает свои электроны катализатору, а азот воспринимает их от катализатора, восстанавливая электронное равновесие. Перегруппировка поверхностных соединений проходит последовательно через низшие соединения азота с водородом: имид NH, амид NH2 и, наконец, аммиак NH3.
Контактную массу готовят сплавлением в атмосфере азота смеси оксидов железа Fe3O4, алюминия Аℓ2O3, калия K2O, кальция СаО и кремния SiO2, или порошков металлических железа и алюминия с оксидами кальция и кремния и карбоната калия с последующим измельчением массы до размеров зерен катализатора (5 мм) и восстановлением их водородом в колонне синтеза аммиака.
Зависимость выхода аммиака от объемной скорости и температуры катализа при давлении 30 Мпа на железном катализаторе показывает, что для каждой объемной скорости имеется оптимальная температура, которой соответствует максимальный выход аммиака, а также с увеличением объемной скорости выход аммиака уменьшается.
Между объемной скоростью и выходом аммиака существует определенная связь через производительность катализатора, под которой понимается съем аммиака (кг) с 1м3 контактной массы в течение 1 ч:
G=0,77 VNNH3,
где 0,77 –масса 1м3 аммиака при нормальных условиях; V-объемная скорость процесса; NNH3 – молярная доля аммиака в газе после катализа.
Увеличение объемной скорости от 15000 до 120000 ч-1, т.е. в 8 раз, снижает максимальный выход аммиака менее чем в 2 раза. Следовательно, увеличение объемной скорости повышает производительность катализатора, так как произведение VNNH3, несмотря на уменьшение NNH3, возрастает. Увеличение объемной скорости газа приводит к росту производительности всей установки в целом, но к некоторому уменьшению выхода аммиака за один цикл.
Условия равновесия процесса и кинетические закономерности его протекания на железных катализаторах обусловливают возможность превращения азота и водорода в аммиак за время их однократного прохождения через аппарат только на 20-40%. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза. Все современные схемы синтеза аммиака являются циркуляционными, предусматривающими выделение аммиака и возвращение непрореагировавшей азотоводородной смеси в цикл синтеза.
Поэтому в таком процессе возможно значительное увеличение объемной скорости. Первые заводы работали при V=5000÷1000ч-1. В настоящее время большинство заводов работают с объемной скоростью до 4000 ч-1. Выбор объемной скорости решается с учетом экономических соображений. С увеличением скорости производительность в целом возрастает, но при этом возрастает и объем непрореагировавших газов, которые необходимо возвращать в цикл, что вызывает увеличение расхода электроэнергии на транспортировку газов, их нагревание, охлаждение увеличение размеров трубопроводов и реакционной аппаратуры. Другим серьезным препятствием к увеличению V является нарушение автотермичности процесса синтеза. При больших объемных скоростях газа в реакцию вступает меньшая доля азота и водорода и теплоты реакции оказывается недостаточно для поддержания необходимой температуры в колонне синтеза. Большие объемные скорости в сочетании с соблюдением оптимального температурного режима, применением азотоводородной смеси высокой степени чистоты и использованием достаточно активных контактных масс должны обеспечить большую производительность цехов синтеза аммиака при высоких экономических показателях процесса.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3222; Нарушение авторских прав?; Мы поможем в написании вашей работы!