
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Для определения ΔНреакции необходимо знать теплоту образования С2Н5ОН(ж)
|
|
|
|
Для определения ΔНреакции необходимо знать теплоту образования С2Н5ОН(ж). Последнюю находим из данных задачи: С2Н5ОН(ж) = С2Н5ОН(г); ΔН = + 42,36 кДж.
+ 42,36 = - 235,31 – ΔНС2Н5ОН(ж).
ΔНС2Н5ОН(ж) = - 235,31 – 42,36 = - 277,67 кДж.
Вычисляем ΔН реакции, применяя следствие из закона Гесса:ΔН = 2(- 393,51) + 3(- 285,84) – (- 277,67) = - 1366,87 кДж.
Пример 4. Растворение 1 моля безводной соды Na2CO3в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидратаNa2CO3∙10H2Oпоглощается 66,94 кДж теплоты. Вычислите теплоту гидратации Na2CO3(теплоту образования кристаллогидрата).
Решение.
Составляем термохимические уравнения соответствующих реакций:
а) Na2CO3 + 10H2O + aq = Na2CO3·aq; ΔН = - 25,10 кДж;
б) Na2CO3∙10H2O + aq = Na2CO3·aq; ΔН = + 66,94 кДж.
Вычитая уравнение (б) из уравнения (а), получаем ответ:
Na2CO3 + 10H2O = Na2CO3∙10H2O; ΔН = - 92,04 кДж, т.е. при образовании Na2CO3·10H2Oвыделяется 92,04 кДж теплоты.
Контрольные задания
121. Определите стандартную энтальпию (∆Н 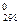 ) образования РН3, исходя из уравнения
) образования РН3, исходя из уравнения
2РН3(г) + 4О2(г) = Р2О5(к) + 3Н2О(ж), ∆Н 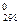 = -2360 кДж.
= -2360 кДж.
Ответ: 5,3 кДж/моль.
122. Вычислите тепловой эффект реакции восстановления одного моля Fe2O3металлическим алюминием. Ответ: - 847,7 кДж.
123. При сгорании 1 дм3 ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H2(г). Ответ: 226,75 кДж/моль.
124. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: - 45,76 кДж.
125. При получении эквивалентной массы гидроксида кальция из CaO(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: -635,6 кДж/моль.
126. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений
FeO(к) + CO(г) = Fe(к) + СО2(г); ΔН = - 13,18 кДж;
СО(г) + ½О2(г) = СО2(г); ΔН = - 283,0 кДж;
Н2(г) + ½О2(г) = Н2О(г); ΔН = - 241,83 кДж.
Ответ: + 27,99 кДж.
127. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: 65,43 кДж.
128. При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж. Найдите объем вступившего в реакцию кислорода (н.у.). Ответ: 296,5 дм3.
129. Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции? Ответ: 206,16 кДж.
130. При взаимодействии газообразных метана и сероводорода образуются сероуглерод СS2(г) и водород. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: +230,43 кДж.
131. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж. Определите ∆Н 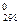 (СuО).
(СuО).
Ответ: -162,1 кДж/моль.
132. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
133. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: -100,26 кДж/моль.
134. Исходя из уравнения реакции
СН3ОН(ж) + 3/2О2(г) = СО2(г) + 2Н2О(ж), ∆Н°298=-726,5 кДж, определите стандартную энтальпию образования метилового спирта (∆Н 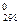 (СН3ОН(ж))). Ответ: -238,6 кДж/моль.
(СН3ОН(ж))). Ответ: -238,6 кДж/моль.
135. Вычислите теплоту образования метана, исходя из следующих термохимических уравнений
Н2(г) + ½О2(г) = Н2О(ж); ΔН = - 285,84 кДж;
С(к) + О2(г) = СО2(г); ΔН = - 393,51 кДж;
СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г); ΔН = - 890,31 кДж.
Ответ: - 74,88 кДж.
136. Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений
Са(к) + ½О2(г) = СаО(к); ΔН = - 635,60 кДж;
Н2(г) + ½О2(г) = Н2О(ж); ΔН = - 285,84 кДж;
СаО(к) + Н2О(ж) = Са(ОН)2(к); ΔН = - 65,06 кДж.
Ответ: - 986,50 кДж.
137. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен –3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(ж). Ответ: + 49,03 кДж/моль.
138. При взаимодействии трех молей гемиоксида азота N2O с аммиаком образуется азот и пары воды. Тепловой эффект реакции равен –877,76 кДж. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования N2O(г). Ответ: +81,55кДж/моль.
139. Реакция горения аммиака выражается термохимическим уравнением 4NH3(г)+3O2(г)=2N2(г)+6H2O(ж); ∆H =-1530,28кДж. Вычислите теплоту образования NH3(г). Ответ: -46,19 кДж/моль.
140. При сгорании газообразного аммиака образуются пары воды и моноксида азота NO(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на один моль NH3(г). Ответ: - 226,18 кДж.
141. Реакция горения метилового спирта выражается термохимическим уравнением: СН3ОН(ж) + 3/2О2(г)=СО2(г) +2Н2О(ж); ΔН =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СН3ОН(ж)равна + 34,4 кДж.
Ответ: - 726,62 кДж.
142. Напишите термохимическое уравнение реакции горения одного моля этилового спирта, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж), если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты. Ответ: - 277,67 кДж.
143. Реакция горения бензола выражается термохимическим уравнением: С6Н6(ж) + 7½О2(г) = 6СО2(г) + 3Н2О(г); ΔН =? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна + 33,9 кДж. Ответ: - 3135,58 кДж.
144. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения одного моля С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия?
Ответ: 63742,86 кДж.
145. Реакция горения аммиака выражается термохимическим уравнением: 4NH3(г) + 3O2(г) =2N2(г) + 6Н2О(ж); ΔН = -1530,28 кДж.
Вычислите теплоту образования NН3(г). Ответ:- 46,19 кДж/моль.
146. Теплота растворения безводного хлорида стронция SrCl2равна – 47,70 кДж, а теплота растворения кристаллогидрата SrCl2·6Н2О равна + 30,96 кДж. Вычислите теплоту гидратации SrCl2.
Ответ: - 78,66 кДж/моль.
147. Теплоты растворения сульфата меди CuSO4 и медного купороса CuSO4·5Н2О соответственно равны – 66,11 кДж и + 11,72 кДж. Вычислите теплоту гидратации CuSO4. Ответ: - 77,83 кДж/моль.
148. Вычислить значение ∆Н0298 для протекающих в организме реакций превращения глюкозы: а) С6Н12О6(К) = 2С2Н5ОН(Ж) + 2СО2(Г);
б) С6Н12О6(Ж) + 6О2(Г) = 6СО2(г) + 6Н2О(Ж). Какая из этих реакций поставляет организму больше энергии?
149. По термохимическому уравнению
4FeSO4(т) = 2Fe2O3 (т) + 4SO2(г) + O2 (г), ∆Н0298 = 886,0 кДж
рассчитайте стандартную энтальпию образования сульфата железа по известным теплотам образования Fe2O3 и SO2.
150. Исходя из термохимических уравнений реакций:
1) KClO3 → KCl + 1,5O2; ∆H0298 = – 49,4 кДж;
2) KClO4 → KCl + 2O2; ∆H0298 = 33 кДж.
Рассчитайте ∆H0298 реакции 4KClO3 → 3KClO4 + KCl.
Ответ: -296,6 кДж.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3880; Нарушение авторских прав?; Мы поможем в написании вашей работы!