
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Используя значения относительных электроотрицательностей атомов (табл
|
|
|
|
Используя значения относительных электроотрицательностей атомов (табл. 4), находим разность относительных электроотрицательностей серы и элемента, образующего с ней химическую связь:
а) сера – калий: 2,6 – 0,91=1,69, электронная пара смещена в сторону атома серы;
б) сера – водород: 2,6 – 2,1 = 0,5, электронная пара смещена в сторону атома серы;
в) сера – бром: 2,6 – 2,74 = -0,14, электронная пара смещена в сторону атома брома;
г) сера – углерод: 2,6 – 2,5 = 0,1, электронная пара смещена в сторону атома серы.
Чем больше по абсолютной величине разность относительных электроотрицательностей, тем более полярна связь. В данном примере наиболее полярной является связь сера – калий, наименее полярной – связь сера – углерод.
Контрольные задания
91. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекул воды?
92. Какая ковалентная связь называется неполярной и какая полярной? Что служит количественной мерой полярности ковалентной связи? Составьте электронные схемы строения молекул N2, Н2О, НI. Какие из них являются диполями?
93. Какой способ образования ковалентной связи называется донорно-акцепторным? Какие химические связи имеются в ионах NН 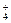 и BF
и BF 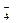 ? Укажите донор и акцептор.
? Укажите донор и акцептор.
94. Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеСl 2 и тетраэдрическое – СН4?
95. Какая ковалентная связь называется σ-связью и какая 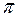 -связью? Разберите на примере строения молекулы азота.
-связью? Разберите на примере строения молекулы азота.
96. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
97. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
98. Что называется дипольным моментом? Какая из молекул HCl, HBr, HI имеет наибольший дипольный момент? Почему?
99. Какие кристаллические структуры называются ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк имеют указанные структуры?
100. Составьте электронные схемы строения молекул Cl2, H2S, ССl4. В каких молекулах ковалентная связь является полярной? Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S?
101. Чем отличается структура кристаллов NaCl от структуры кристаллов натрия? Какой вид связи осуществляется в этих кристаллах? Какие кристаллические решетки имеют натрий и NaCl? Чему равно координационное число натрия в этих решетках?
102. Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
103. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
104. Укажите тип химической связи в молекулах Н2, Cl2, HCl. Приведите схему перекрывания электронных облаков.
105. Пользуясь таблицей относительных электроотрицательностей, вычислите их разность для связей K – Cl, Ca – Cl, Fe –Cl, Ge –Cl. Какая из связей характеризуется наибольшей степенью ионности?
106. Какой характер имеют связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO2? Укажите для каждой из них направление смещения общей электронной пары.
107. Почему не могут существовать устойчивые молекулы Ве2 и Nе2?
108. Какие типы гибридизации АО углерода соответствуют образованию молекул СН4, С2Н2, С2Н4, С2Н6?
109. Объясните с позиции метода ВС способность оксидов NO и NO2 образовывать димерные молекулы.
110. Какая из связей Са – Н, С – S, О –Cl является наиболее полярной? К какому из атомов смещено молекулярное электронное облако?
111. Как метод молекулярных орбиталей объясняет большую энергию диссоциации молекулы азота? Нарисуйте энергетическую схему образования молекулы N2. Сколько электронов находится на связывающих и разрыхляющих орбиталях?
112. Молекула хлорида бора BCl3 имеет плоскую структуру, а хлорида азота NCl3 – пирамидальную. Чем объясняется такое различие?
113. Какие гибридные облака атома углерода участвуют в образовании химической связи в молекулах CCl4, CO2?
114. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов в соединениях CH4, CH3OH, HCOOH, CO2.
115. Сравните способы образования ковалентных связей в молекуле NH3 и в ионе NH  .
.
116. Какие силы молекулярного взаимодействия называются ориентационными, индукционными и дисперсионными? Когда возникают и какова природа этих сил?
117. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Zn(NH3)4]2+. Укажите донор и акцептор. Как метод валентных связей объясняет тетраэдрическое строение этого иона?
118. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей объясняет симметричную треугольную форму молекулы BF3?
119. Как метод молекулярных орбиталей объясняет парамагнитные свойства молекулы кислорода? Нарисуйте энергетическую схему образования молекулы О2 в методе молекулярных орбиталей.
120. Нарисуйте энергетическую схему образования молекулы F2 в методе молекулярных орбиталей.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3132; Нарушение авторских прав?; Мы поможем в написании вашей работы!