
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Энтропия есть мера неупорядоченного состояния вещества
|
|
|
|
Решение.
Энтропия есть мера неупорядоченного состояния вещества. В кристалле частицы (атомы, ионы) имеют упорядоченное расположение и могут находиться лишь в некоторых точках пространства, а для газа таких ограничений нет. 1 моль газа имеет гораздо больший объем, чем 1 моль кристалла, и возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия моля паров вещества больше энтропии моля его кристаллов при одинаковой температуре: Sг > Sж > Sк.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе СН4(г) + СО2(г) ↔ 2СО(г) + 2Н2(г)?
Для ответа на вопрос следует вычислить ΔG 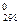 прямой реакции. Значения ΔG
прямой реакции. Значения ΔG 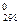 соответствующих веществ даны в табл. 4. Зная, что ΔG
соответствующих веществ даны в табл. 4. Зная, что ΔG 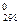 есть функция состояния и что ΔG
есть функция состояния и что ΔG 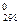 для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим ΔG
для простых веществ, находящихся в агрегатных состояниях, устойчивых при стандартных условиях, равны нулю, находим ΔG 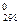 процесса:
процесса:
ΔG 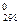 = (2∙ΔG
= (2∙ΔG 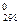 (CO) + 2∙ΔG
(CO) + 2∙ΔG 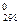 (H2)) – (ΔG
(H2)) – (ΔG 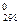 (CH4) + ΔG
(CH4) + ΔG 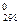 (CO2)) =.
(CO2)) =.
= (2(-137,27) + 2(0)) – (- 50,79 – 394,38) = +170,63 кДж.
То, что ΔG 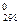 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 101,325 кПа.
> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и равенстве давлений взятых газов 101,325 кПа.
Пример 3. На основании стандартных теплот образования (табл. 4) и абсолютных стандартных энтропий веществ (табл. 4) вычислите ΔG 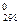 реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
СО(г) + Н2О(ж) = СО2(г) + Н2(г).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 491; Нарушение авторских прав?; Мы поможем в написании вашей работы!