
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе
|
|
|
|
ИОННО-МОЛЕКУЛЯРНЫЕ (ИОННЫЕ) РЕАКЦИИ ОБМЕНА
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClО и НNO3; г) К2СО3 и Н2SO4; д) СН3СООН и NaOH.
Взаимодействие этих веществ возможно либо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, HСlO), осадка (PbS↓), газа (СО2↑). Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) НСl + NaOH = NaCl + H2O,
в ионном виде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + Н2O,
исключив одинаковые ионы Na+ и Cl- из обеих частей равенства, получим краткое инно-молекулярное уравнение:
Н+ + ОН- =Н2О.
б) Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3;
Pb2+ + 2NO 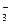 + 2Na+ + S2- = PbS↓+ 2Na+ + 2NO
+ 2Na+ + S2- = PbS↓+ 2Na+ + 2NO 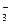 ;
;
Pb2+ + S2- = PbS↓.
в) NaClO + HNO3 = NaNO3 + HClO;
Na+ + ClO- + H+ + NO 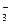 = Na+ + NO
= Na+ + NO 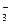 + HClO;
+ HClO;
H+ + ClO- = HClO.
г) K2CO3 + H2SO4 = K2SO4 + CO2↑ + H2O;
2K+ + CO 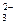 + 2H+ + SO
+ 2H+ + SO 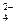 = 2K+ + SO
= 2K+ + SO 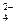 + CO2↑ + H2O;
+ CO2↑ + H2O;
CO 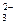 + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
д) В реакции два слабых электролита (СН3СООН и H2O), но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит (константа диссоциации воды 1,8 · 10-16 (табл. 6)), чем уксусная кислота (константа диссоциации уксусной кислоты 1,8 · 10-5 (табл.6)), равновесие реакции смещено в сторону образования воды:
СН3СООН + NaOH = CH3COONa + H2O;
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O;
CH3COOH + OH- = CH3COO- + H2O.
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
a) SO 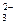 + 2H+ = SO2 + H2O;
+ 2H+ = SO2 + H2O;
b) Pb2+ CrO 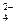 = PbCrO4;
= PbCrO4;
c) HCO 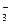 + OH- = CO
+ OH- = CO 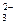 + H2O;
+ H2O;
d) ZnOH+ + H+ = Zn2+ + H2O.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3120; Нарушение авторских прав?; Мы поможем в написании вашей работы!