
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение
|
|
|
|
Решение.
Коагулирующая способность сульфата натрия по отношению к золю выше коагулирующей способности хлорида кальция. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов больше, чем у CaCl2. Значит, коагулирующими ионами являются анионы. Следовательно, частицы золя заряжены положительно.
Пример 3. Порог коагуляции золя серебра ионами алюминия равен 0,186 ммоль/л. Какой объем 28%-ного раствора сульфата алюминия (пл. 1,33 г/мл) требуется для коагуляции золя объемом 2 л?
Рассчитаем молярную концентрацию 28%-ного раствора сульфата алюминия, подставив известные по условию задачи величины и молярную массу сульфата алюминия:
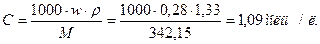
Поскольку С(Al3+) = 2C(Al2(SO4)3), концентрация иона коагулятора равна 2∙1,09 моль/л = 2,18 моль/л = 2180 ммоль/л.
Из уравнения для расчета порога коагуляции 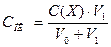 , где V0 – объем золя, V1 – минимальный объем электролита, вызвавший коагуляцию, выразим объем электролита:
, где V0 – объем золя, V1 – минимальный объем электролита, вызвавший коагуляцию, выразим объем электролита:
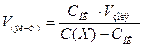 .
.
Подставим в это выражение известные по условию задачи величины и вычислим:
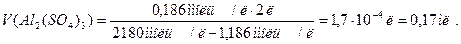
Ответ: для коагуляции требуется 0,17 мл раствора сульфата алюминия.
Контрольные задания
331. Золь гексацианоферрата (II) меди (II) получен в условиях избытка: а) хлорида меди; б) гексацианоферрата (II). Напишите формулы мицеллы обоих золей и назовите их составные части.
332. Напишите формулу мицеллы для золя йодида серебра, полученного добавлением к раствору йодида калия объемом 30 мл с концентрацией 0,006 моль/л раствор нитрата серебра объемом 40 мл с концентрацией 0,004 моль/л. Напишите части мицеллы.
333. Золь бромида свинца (II) получен при смешивании растворов ацетата свинца и бромида кальция. Коагулирующая способность нитрата магния по отношению к этому золю больше коагулирующей способности сульфата аммония. Напишите формулы мицеллы и назовите ее составные части.
334. Золь гидроксида магния был получен смешиванием равных объемов растворов хлорида магния с концентрацией 0,01 моль/л и гидроксида калия с концентрацией 0,015 моль/л. Напишите формулу мицеллы, назовите ее составные части и укажите, какой из электролитов: хлорид калия, сульфат натрия, нитрат алюминия – будет обладать наибольшей коагулирующей способностью к полученному золю.
335. Смешали равные объемы 1%-ных растворов хлорида кальция и серной кислоты (плотности принять равными 1 г/мл). Напишите формулу мицеллы образовавшегося золя и назовите ее составные части.
336. Для получения коллоидного раствора Fe4[Fe(CN)6]3 к раствору FeCl3 с концентрацией 0,008 моль/л и объемом 8 мл добавили К4[Fe(CN)6] с концентрацией 0.007 моль/л и объемом 6 мл. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Формулу мицеллы, назовите составные части. 3. К какому электроду будет перемещаться дисперсная фаза при электрофорезе? 4. Какой ион К2SO4 вызывает коагуляцию золя?
337. Коллоидный раствор Cr(OH)3 получен при прибавлении 3 мл 10%-ного водного раствора Cr2(SO4)3 (ρ=1,1г/см3) и 5мл 5%-ного раствора (NH4)2S (ρ=1,05г/см3). Какова формула мицеллы коллоидного раствора?
338. Какие золи: гидроксида железа, иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
339. Какой объем раствора AgNO3 с концентрацией 0,001 моль/л следует добавить к раствору NaCl объемом 10 мл с концентрацией 0,002 моль/л, чтобы получился золь, гранулы которого заряжены положительно? Напишите схему строения мицеллы золя.
Ответ: > 20 мл.
340. Получены два золя иодида серебра из растворов AgNO3 и KI с молярными концентрациями по 0,05 моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16 мл к раствору KI объемом 20 мл, другой – раствора KI объемом 16 мл к раствору AgNO3 объемом 20 мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте. Напишите формулы мицеллей.
341. Коагуляция золя гидроксида железа (III) объемом 4 л наступила при добавлении 10%-ного раствора сульфата магния объемом 0,91 мл (плотность 1,1г/мл). Вычислите порог коагуляции золя сульфат-ионами. Ответ: 0,21 ммоль/л.
342. Порог коагуляции золя гидроксида железа фосфат-ионами равен 0,37 ммоль/л. Какой объем 5%-ного раствора Na3PO4 (пл. 1,05 г/мл) требуется для коагуляции золя объемом 750 мл? Ответ: 0,87 мл.
343. Для получения коллоидного раствора Сu(OH)2 к раствору KOH с концентрацией 0,005 моль/л и объемом 5 мл добавили CuSO4 с концентрацией 0,025 моль/л и объемом 10 мл. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Формулу мицеллы, назовите составные части. 3. К какому электроду будет перемещаться дисперсная фаза при электрофорезе? 4. Какой ион NaCl вызывает коагуляцию золя?
344. При добавлении 50 мл золя оксида алюминия 0,4 мл раствора K2SO4 с концентрацией 0,02 моль/л наблюдается начало явной коагуляции. Рассчитайте порог коагуляции (ммоль на литр золя) и коагулирующую способность сульфата по отношению к золю оксида алюминия.
345. К 100 см3 0,03%-ного раствора хлористого натрия (плотность 1005 кг/м3) добавлено 250 см3 0,001 н раствора азотнокислого серебра. Для изучения коагуляции к полученному золю хлористого серебра добавлены следующие электролиты KBr, Ba(NO3)2, K2CrO4, MgSO4, AlCl3. Какой из добавленных электролитов имеет наименьший порог коагуляции, наименьшую коагулирующую способность? Ответ мотивируйте. Напишите формулу мицеллы.
346. Золь AgI получен при добавлении 8 мл водного раствора KI концентрацией 0,05 моль/л к 10мл водного раствора AgI концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя. Как заряжена частица? Каким методом можно определить этот заряд?
347. Порог коагуляции золя гидроксида алюминия дихромат-ионами равен 0,63 ммоль/л. Какой объем 10%-ного раствора дихромата калия (пл. 1,07 г/мл) требуется для коагуляции золя объемом 1,5л?
348. Золь сернокислого бария получен смешением равных объемов растворов азотнокислого бария и серной кислоты. Написать формулу мицеллы золя и ответить на вопрос, одинаковы ли исходные концентрации электролитов, если в электрическом поле гранула перемещается к аноду.
349. Коллоидный раствор получен в результате реакции обмена при смешивании равных объемов растворов FeCl3 с концентрацией 0,01 моль/л и NaOH с концентрацией 0,005 моль/л. Напишите формулу мицеллы коллоидного раствора и схему ее строения. В каком направлении (к катоду или аноду) будет перемещаться гранула? Определите, какой из электролитов K2SO4 или KCl будет иметь меньший порог коагуляции?
350. Какой минимальный объем раствора дихромата калия с концентрацией 0,01 моль/л требуется для коагуляции гидрозоля гидроксида железа (III) объемом 1 л, если порог коагуляции этого золя дихромат-ионом равен 0,06 моль/л?
351. Пороги коагуляции гидрозоля гидроксида железа (III) сульфатом натрия и хлоридом алюминия соответственно равны 0,32 и 20,50 ммоль/л. Определите знак заряда коллоидных частиц золя. Вычислите величины коагулирующей способности этих электролитов и сопоставьте их отношение с вычисленными по правилу Шульце-Гарди.
352. Какой минимальный объем раствора сульфида аммония с концентрацией 0,001 моль/л следует добавить к раствору хлорида марганца (II) объемом 15 мл с концентрацией 0,003 моль/л для того, чтобы получить золь с отрицательно заряженными частицами? Напишите схему строения мицеллы золя.
353. Золь иодида серебра был получен при смешивании растворов нитрата серебра и иодида аммония. Коагулирующая способность хлорида магния по отношению к этому золю больше коагулирующей способности сульфата натрия. Напишите формулу мицеллы этого золя и назовите ее составные части.
354. Порог коагуляции золя иодида серебра сульфат-ионами равен 2,12 ммоль/л. Какой объем раствора сульфата алюминия с концентрацией 0,4 моль/л требуется для коагуляции золя объемом 0,5 л? Напишите формулу золя иодида серебра.
355. Пороги коагуляции золя Fe(OH)3 для электролитов KI и K2Cr2O7 соответственно равны 10,0 и 0,195 ммоль на 1 л золя. Во сколько раз коагулирующая способность двухромового калия больше, чем у иодистого калия?
356. Для получения коллоидного раствора сульфата бария к раствору BaCl2 с С(BaCl2) = 0,005 моль/л и объемом 10 мл добавили 20 мл K2SO4 с С(K2SO4) = 0,002 моль/л. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Потенциалобразуюшие ионы, противоионы. 3. Формулу мицеллы; назвать ее составные части. 4. Знак заряда золя. 5. К какому электроду будет перемещаться дисперсная фаза при электрофорезе. 6. Какой ион электролита KNO3 вызывает коагуляцию золя?
357. Коагуляция золя сульфида золя объемом 650 мл наступила при добавлении раствора сульфата хрома (III) объемом 1,18 мл с концентрацией 0,025 моль/л. Вычислите порог коагуляции золя сульфат-ионами. Напишите формулу мицеллы золя сульфида золота.
358. Порог коагуляции золя сульфида золота ионами кальция равен 0,69 ммоль/л. Какой объем раствора хлорида кальция с концентрацией 0,5 моль/л требуется для коагуляции золя объемом 100 мл? Напишите формулу мицеллы золя сульфида золота.
359. К 5 см3 золя гидроксида железа (III) для начала явной коагуляции необходимо добавить один из следующих растворов: 4 см3 3н раствора хлористого калия; 0,5 см3 0,01н раствора сернокислого калия; 3,9 см3 0,0005 н раствора железистосинеродистого калия. Вычислить порог коагуляции для этих электролитов. Во сколько раз коагулирующая способность К4[Fe(CN)6] выше, чем у K2SO4 и KCl?
360. Пороги коагуляции золя сульфида мышьяка для нитрата калия, хлорида магния и хлорида алюминия соответственно равны 50, 0,72 и 0,093 ммоль/л. Как соотносятся между собой коагулирующие способности электролитов? Катионы или анионы вызывают коагуляцию? Ответ обоснуйте. Напишите формулу мицеллы золя сульфида мышьяка.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 22285; Нарушение авторских прав?; Мы поможем в написании вашей работы!