
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Под гидролизом понимают реакцию разложения молекул воды солями (от греческих слов: «гидро» – вода, «лизис» – разложение)
|
|
|
|
ГИДРОЛИЗ СОЛЯМИ
Под гидролизом понимают реакцию разложения молекул воды солями (от греческих слов: «гидро» – вода, «лизис» – разложение). В большинстве случаев реакция гидролиза имеет обратимый характер и приводит к изменению pH. Разлагать (гидролизовать) молекулу воды может только тот из двух ионов соли, который является остатком слабого электролита.
К слабым электролитам относятся все нерастворимые основания (Cu(OH)2, Zn(OH)2, Fe(OH)3 и т.д.), одно растворимое основание (NH4OH), некоторые неорганические кислоты (HF, H2SO3, H2S, HNO2, H3PO4, H3PO3, HCN), почти все органические кислоты и основания.
К сильным электролитам принадлежат все растворимые в воде соли, основания-щелочи (NaOH, KOH, Ca(OH)2, Ba(OH)2 и т.д.), некоторые неорганические кислоты (HCl, HBr, HI, H2SO4, HNO3).
Соли, образованные сильным основанием и сильной кислотой (NaCl, K2SO4, Ca(NO3)2 и т.д.), не гидролизуют воду. В растворах таких солей среда нейтральная (рН=7).
Гидролиз протекает в трех случаях: если соль образована слабым основанием и сильной кислотой, сильным основанием и слабой кислотой, слабым основанием и слабой кислотой.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) КСN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
А. Цианид калия КСN – соль слабой одноосновной кислоты НСN и сильного основания КОН. При растворении в воде молекулы КСN полностью диссоциируют на катионы К+ и анионы СN-
КСN ↔ К+ + СN-.
Катионы К+ не могут связывать ионы ОН- воды, так как КОН – сильный электролит. Анионы же СN- связывают ионы Н+ воды, образуя молекулы слабого электролита НСN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
СN-+НОН 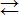 НСN+ОН-,
НСN+ОН-,
или в молекулярной форме
КСN+Н2О 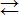 НСN+КОН.
НСN+КОН.
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор КСN имеет щелочную реакцию (рН>7).
Б. Карбонат натрия Na2CO3 – соль слабой двуосновной кислоты Н2СО3 и сильного основания NaOH. При растворении в воде молекулы Na2CO3 полностью диссоциируют на катионы Na+ и анионы CO 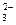 :
:
Na2CO3 ↔ 2Na+ + CO 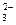 .
.
В этом случае анионы соли CO 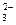 , связывая водородные ионы воды, образуют анионы кислой соли HCO
, связывая водородные ионы воды, образуют анионы кислой соли HCO 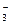 , а не молекулы Н2СО3, так как ионы HCO
, а не молекулы Н2СО3, так как ионы HCO 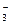 диссоциируют гораздо труднее, чем молекулы Н2СО3. В стандартных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону.
диссоциируют гораздо труднее, чем молекулы Н2СО3. В стандартных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону.
Ионно-молекулярное уравнение гидролиза
CO 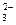 + НОН
+ НОН 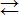 HCO
HCO 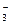 + ОН-,
+ ОН-,
или в молекулярной форме
Na2СО3+Н2О 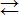 NaHCO3+NaOH.
NaHCO3+NaOH.
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
В. Сульфат цинка ZnSO4 – соль слабого двукислотного основания Zn(OH)2 и сильной кислоты Н2SO4.
ZnSO4 ↔ Zn2+ + SO 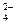 .
.
В этом случае катионы Zn2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону.
Ионно-молекулярное уравнение гидролиза
Zn2++НОН 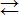 ZnOH++H+
ZnOH++H+
или в молекулярной форме
2ZnSO4+2Н2О 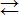 (ZnOH)2SO4+Н2SO4.
(ZnOH)2SO4+Н2SO4.
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов Al(NO3)3 и К2СО3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1228; Нарушение авторских прав?; Мы поможем в написании вашей работы!