
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота №4
|
|
|
|
1. Тема: Гідроксильні сполуки і їх похідні.
2. Мета: Вивчити властивості етилового спирту і гліцерину.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ:
3.1 Етиловий спирт, гліцерин.
3.2 СuSO4 2 н розчин
3.3 Фенолфталеїн 1 %-ий розчин, лакмус 1 %-ий розчин.
3.4 Натрій металічний.
3.5 Хромова суміш, Н2SO4 концентрована.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
4.1 Відношення спиртів до індикатора.
4.1.1 Хід роботи: в пробірку дають 3 краплі води і додають 2 краплі етанолу. Перевіряємо на фенолфталеїн і лакмус.
4.1.2 Спостереження: забарвлення індикаторів не змінюється
4.1.3 Хімізм реакцій:
4.1.4 Висновок: спирти – практично нейтральні речовини.
4.2 Утворення і гідроліз алкоголятів.
4.2.1 Хід роботи: в суху пробірку поміщають металічний натрій, додають 3 краплі етилового спирту і закривають пробірку пальцем. По закінченню реакції підносять пробірку до полум’я пальника і забирають палець. В отворі пробірки загоряється водень, який виділяється. Залишок натрію етилату розчиняють в 2-3 краплях дистильованої води і додають 1 краплю фенолфталеїну.
4.2.2 Спостереження: з’являється малинове забарвлення
4.2.3 Хімізм реакцій: С2Н5ОН + Na → C2H5ONa + ½H2 C2H5ONa + H – OH → C2H5OH + NaOH
4.2.4 Висновок: атоми водню гідроксильних груп в спиртах проявляють певну активність. В спиртах слабо виражені кислотні властивості.
4.3 Окислення етилового спирту купрум (ІІ) оксидом.
4.3.1 Хід роботи: в пробірку поміщають 2 краплі етилового спирту. Тримаючи пінцетом спіраль з мідною дротиною нагрівають її в полум’ї пальника до появи чорного нальоту CuO. Гарячу спіраль опускають в пробірку з етиловим спиртом.
4.3.2 Спостереження: чорна поверхня спіралі стає золотистою внаслідок відновлення CuO. Відчуваємо запах оцтового альдегіду (запах яблука).
4.3.3 
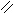 Хімізм реакцій: С2Н5ОН + CuO → CH3 – C + Cu + H2O
Хімізм реакцій: С2Н5ОН + CuO → CH3 – C + Cu + H2O
О H
4.3.4 Висновок: окислення С2Н5ОН купрум (ІІ) оксидом є
якісною реакцією.
4.4 Окислення етилового спирту хромовою сумішшю.
4.4.1 Хід роботи: в суху пробірку поміщають 2 краплі етилового спирту і додають 1 краплю розчину хромової суміші. Нагрівають.
4.4.2 Спостереження: розчин стає синьо-зеленого кольору, одночасно відчувається запах оцтового альдегіду.
4.4.3 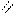 Хімізм реакцій: O
Хімізм реакцій: O
 3С2Н5ОН + K2Cr2O7 + H2SO4 → 3CH3 – C + Cr2(SO4)3 + K2SO4 + 7H2O
3С2Н5ОН + K2Cr2O7 + H2SO4 → 3CH3 – C + Cr2(SO4)3 + K2SO4 + 7H2O
H
4.4.4 Висновок: при окисленні спиртів в першу чергу окислюється карбон, біля якого знаходиться гідроксильна група.
4.5 Взаємодія гліцерину з купрум (ІІ) гідроксидом.
4.5.1 Хід роботи: помістити в пробірку 2 краплі розчину купрум (ІІ) сульфату, 2 краплі розчину їдкого натру і перемішати, в пробірку додати 1 краплю гліцерину і розбовтати.
4.5.2 Спостереження: з’являється темно-синє забарвлення.
4.5.3 Хімізм реакцій:



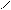
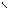 Н2С – ОН HO – CH2 H2C – O O – CH2
Н2С – ОН HO – CH2 H2C – O O – CH2


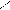
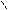

 НС – ОН + НО – Cu – OH + HO – CH → HC – O → Cu ← O – CH + 2H2O Н2С – ОН HO – CH2 HOH2C H H CH2OH
НС – ОН + НО – Cu – OH + HO – CH → HC – O → Cu ← O – CH + 2H2O Н2С – ОН HO – CH2 HOH2C H H CH2OH
4.5.4  Висновок: кислотні властивості трьохатомного спирту більш виражені, ніж одноатомного. Збільшення кількості гідроксильних груп підвищує кислотний характер.
Висновок: кислотні властивості трьохатомного спирту більш виражені, ніж одноатомного. Збільшення кількості гідроксильних груп підвищує кислотний характер.
4.6 Отримання діетилового етеру.
4.6.1 Хід роботи: в суху пробірку внести 2 краплі етилового спирту і 2 краплі сульфатної кислоти. Суміш обережно нагріти над полум’ям пальника до побуріння розчину. До гарячої суміші дуже обережно добавити ще 2 краплі етилового спирту.
4.6.2 Спостереження: відчувається характерний запах діетилового етеру.

4.6.3 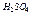 Хімізм реакцій: С2Н5ОН + НОС2Н5 →С2Н5 – О – С2Н5+ Н2O
Хімізм реакцій: С2Н5ОН + НОС2Н5 →С2Н5 – О – С2Н5+ Н2O
4.6.4 Висновок: відбувається міжмолекулярна дегідратація.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Промислові і лабораторні способи одержання спиртів.
2. Описати хімічні властивості спиртів на прикладі ізопропілового спирту.
3. Як здійснити такі синтези:
· СН4 ® С2Н5ОН;
· С2Н4 ® вторбутиловий спирт;
· СН4 ® купруму гліцерат;
· С2 Н4 ® етилацетат.
Література:
А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Гл. 5. Досл. 48-52, 55.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2095; Нарушение авторских прав?; Мы поможем в написании вашей работы!