
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 3
1. ТЕМА. Ароматичні вуглеводні.
2. МЕТА: Вивчити властивості бензену, толуену і нафталену.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ:
3.1 Бензен, толуен, нітробензен, нафтален;
3.2 Бромна вода, КМnO4 0.1 н, H2SO4 2н, HNO3(конц.),
3.3 Фарфорова лодочка, водяна баня, термометр.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
4.1 Горіння бензену.
4.1.1. Хід роботи: в фарфорову чашку поміщають 1 краплю бензену і підпалюють.
4.1.2. Спостереження: бензен горить яскравим кіптявим полум’ям.
4.1.3. Хімізм: 2С6Н6 + 15О2 → 12СО2 + 6Н2О
4.1.4. Висновок: бензен - горючий вуглеводень.
4.2. Дія бромної води на бензен.
4.2.1. Хід роботи: в пробірку поміщають 3 краплі бромної води і 2 краплі бензену. Вміст пробірки енергійно збовтують і дають відстоятися.
4.2.2. Спостереження: нижній шар бромної води знебарвлюється, а верхній шар бензену забарвлюється в коричнево-жовтий колір.
4.2.3.  Хімізм:
Хімізм:
+ Br2 ≠
4.2.4. Висновок: бром легше розчиняється в бензені, ніж у воді, і тому переходить у верхній бензенний шар. Приєднання брому в даних умовах не проходить.
4.3. Дія перманганату калію.
4.3.1. Хід роботи: в пробірку поміщають 3 краплі води, 1 краплю розчину перманганату калію і краплю розчину H2SO4. До одержаного розчину додають краплю бензену і збовтують вміст пробірки.
4.3.2.  Спостереження: розчин калію перманганату зберігає своє забарвлення.
Спостереження: розчин калію перманганату зберігає своє забарвлення.
4.3.3. Хімізм: + 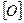 ≠
≠
4.3.4. Висновок: бензен, як і всі ароматичні вуглеводні, стійкий до дії окисників.
4.4.Окислення гомологів бензену.
4.4.1. Хід роботи: в пробірку поміщаємо 3 краплі води, краплю розчину перманганату калію і краплю розчину сульфатної кислоти, потім додаємо краплю толуену і енергійно збовтуємо протягом 1-2 хв.
4.4.2. Спостереження: рожеве забарвлення поступово зникає.
 O
O
4.4.3. 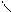 Хімізм реакцій: С6Н5 – СН3+3
Хімізм реакцій: С6Н5 – СН3+3 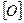 →C6H5C + H2O
→C6H5C + H2O
OH
4.4.4. Висновок: гомологи бензену окислюються набагато швидше, ніж бензин.
4.5 Нітрування бензену.
4.5.1 Хід роботи: В суху пробірку поміщають 2 краплі концентрованої нітратної кислоти, 3 краплі концентрованої сульфатної кислоти. Одержану суміш охолоджують і додають 2 краплі бензену, поміщають на водяну баню, нагріту 50- 55°С на 2 хв.
4.5.2 Спостереження: коли вміст пробірки перелити в іншу пробірку з водою на дно осяде важкий жовтуватий нітробензен.
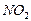
4.5.3 

 Хімізм реакцій: + НО – NO2 → + H2O
Хімізм реакцій: + НО – NO2 → + H2O
4.5.4 Висновок: за допомогою даного досліду ми одержали нітробензен.
4.6 Бромування ароматичних вуглеводнів.
4.6.1 Хід роботи: для проведення досліду беруть 2 сухі пробірки. В одну пробірку поміщають 2 краплі бензену, в другу -2 краплі толуену. В обидві пробірки додають по краплі розчину брому і збовтують протягом 1-2 хв. Вміст обидвох пробірок нагрівають до кипіння.
4.6.2 Спостереження:в пробірці з толуеном р-н з бромом знебарвлюється СН3 СН3
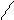

 Вr
Вr

 4.6.3 Хімізм реакцій:: + Br2 → + НВr
4.6.3 Хімізм реакцій:: + Br2 → + НВr
4.6.4 Висновок: група - СН3 є замісником І роду.
4.7 Вплив каталізатора на бромування ароматичних вуглеводнів.
4.7.1 Хід роботи: в 3 пробірки наливаємо досліджуваного вуглеводню (дослід проводимо з бензеном і толуеном паралельно). В першу пробірку поміщаємо кристалик йоду, в другу - залізних ошурок, в третю - каталізатора не даємо.В пробірках з бензеном на холоді змін не відбувається, тому їх нагрівають на водяній бані до кипіння. Пробірки з толуеном лишаємо при кімнатній температурі,часто збовтуючи.
4.7.2 Спостереження: В трьох пробірках з бензином за звичайних умов зміни не відбуваються. Після нагрівання виділення бромоводню спостерігається в присутності заліза. Бромування толуолу проходить значно легше.
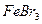 4.7.3 Хімізм реакцій: 2Fe + 3Br2 = 2 FeBr3
4.7.3 Хімізм реакцій: 2Fe + 3Br2 = 2 FeBr3
Br


 + Br2 → + HBr
+ Br2 → + HBr
 СН3
СН3

 СН3Вr
СН3Вr

 + Br2 →
+ Br2 →
+ НВr


 → СН3 Вr
→ СН3 Вr
4.7.4 Висновок: Бромування толуолу проходить значно легше, ніж бромування бензолу.
4.8 Нітрування нафталену.
4.8.1 Хід роботи: в суху пробірку поміщають кристалик нафталену, 3 краплі нітратної кислоти, 2 краплі сульфатної кислоти. На водяній бані суміш нагрівають 2-3 хв. Гарячий розчин виливають у пробірку з холодною водою.
4.8.2 Спостереження: нафтален опускається на дно у вигляді оранжевої маслянистої рідини, яка твердне при збовтуванні.
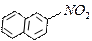 | |||
 |
4.8.3 Хімізм реакцій: + НО – NO2 → + H2O
4.8.4 Висновок: ми добули нітронафтален. Нітрування нафталену проходить легше, ніж нітрування бензену.
4.9 Возгонка нафталену (сублімація).
4.9.1 Хід роботи: в суху пробірку поміщають кристалик нафталену і закріплюють її у штативі. Верхню половину пробірки обгортають вологим фільтрувальним папером і починають обережно нагрівати дно пробірки.
4.9.2 Спостереження: у охолоджуваній частині пробірки утворяться кристали нафталену.
4.9.3 Хімізм реакцій: -
4.9.4 Висновок: сублімація нафталену є одним із способів його очистки.
КОНТРОЛЬНІ ЗАПИТАННЯ:
1. Методи одержання гомологів бензену.
2. Написати рівняння реакцій хімічних властивостей бензену, толуену, нафталену.
3. Здійснити синтези
· З метану ® 2,4,6-тринітротолуен.
· З етилену ® бромбензен.
· З ацетилену ® нітробензен.
4. Скільки літрів Гідрогену необхідно для перетворення 100 г нафталену в декалін?
5. Із 78 г толуену при реакції нітрування було одержано 69 г о-нітротолуену. Скільки відсотків це становить від теоретичного виходу?
ЛІТЕРАТУРА:
· А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Глава 3. Досл. 26,27,31,33. Глава 8. Досл. 136.
|
|
Дата добавления: 2015-05-26; Просмотров: 803; Нарушение авторских прав?; Мы поможем в написании вашей работы!