
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные свойства s- металлов
|
|
|
|
Химические свойства
Получение водородпероксида
Физические свойства
Н2О2 – бесцветная вязкая жидкость с неприятным «металлическим» привкусом. t°кип. = 150,2°С; t°пл. = -0,43°С; плотность = 1,45 г/см3. Хороший растворитель; хорошо смешивается с Н2О.
ВаО2 + H2SO4 = H2O2 + ВаSO4
1. В водных растворах перекись водорода – слабая кислота:
 (К1 = 2,2 × 10-12).
(К1 = 2,2 × 10-12).
оксоний - водородпероксид-
ион ион
2. Соединение неустойчиво, при хранении разлагается:
2Н2О2 ® 2Н2О + О2.
3. В окислительно-восстановительных реакциях Н2О2 и её производные прежде всего окислители, но в присутствии сильного окислителя Н2О2 может быть восстановителем:
а) NaVO3 + H2O2 + HCl = HVO4 + NaCl + H2O
в – ль о - ль
(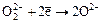 );
);
б) Ag2O + H2O2 = 2Ag + O2 + H2O
в – ль
(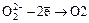 ).
).
ЩЕЛОЧНЫЕ – металлы 1 группы, главной подгруппы.
Электронное строение валентных орбиталей ns1. Называются так потому, что водные растворы их оксидов – сильные основания («щёлочи»):
Ме2О+ Н2О = 2МеОН.
Li, Na, K, Rb, Cs, Fr(радиоактивен), сверху вниз по подгруппе металлические свойства растут.
Физические свойства
Мягкие, лёгкие, серебристые, режутся ножом. Rb и Cs существуют в виде паст. Из-за высокой склонности к окислению их хранят под слоем керосина или вазелинового масла.
Химические свойства -
очень активны.
1. Реакции с простыми веществами
а) 4Na + O2 = 2Na2O оксид;
б) 2Na + Н2 = 2NаН гидрид;
в) 2Na + F2 = 2NaF фторид;
г) 6Na + N2 = 2Na3N нитрид;
д) 2Na + S = Na2S сульфид;
е) 3Na + Р= Na3Р фосфид;
ж) 4Na + Si= Na4Si силицид.
2. Реакции со сложными веществами:
а) 2Na + 2Н2О = 2NaОН + Н2;
б) 2Na + 2НСl = 2NaCl + Н2;
в) Реакции с Н2SO4 k и HNО3 идут по-разному (см. взаимодействие кислот со щелочно-земельными металлами).
Некоторые соединения Na и K
NаОН – едкий натр; каустическая сода;
NаНСО3 – питьевая сода;
Nа2СО3 – техническая (кальцинированная) сода;
К2СО3 – поташ.
ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ – металлы 2 группы
главной подгруппы.
Электронное строение валентных орбиталей ns2. Историческое название оксидов – «земли», при растворении в воде также получаются щёлочи, отсюда и название «щелочно-земельные»
МеО + Н2О = Ме(ОН)2.
земли щелочи
Не все металлы этой подгруппы обладают высокой активностью:
Ве – амфотерен; ВеО, Ве(ОН)2 – тоже амфолиты;
Mg – переходный металл; Mg(OH)2 – основание средней силы, малорастворимо; Са – щелочной металл; Са(ОН)2 – малорастворимое сильное основание;
Sr – щелочной металл, Sr(OH)2 – растворимое сильное основание;
Ва – щелочной металл; Ва(ОН)2 – растворимое сильное основание;
Rа – радиоактивен.
Химические свойства
Для Са, Sr и Ва характерны те же химические реакции, что и для щелочных металлов. Следует особо выделить реакции очень активных металлов, Mg и Ве с Н2SO4 конц. и HNO3.
1. Щелочные и щелочно-земельные металлы восстанавливают S+6
в реакции с Н2SO4 конц . максимально;
Mg – в меньшей степени;
Ве реагирует с кислотой как малоактивный металл:
а) 8Na + 5H2SO4 = 4Na2SO4 + H2S + 4H2O;
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O;
б) 3Mg + 4H2SO4 = 3MgSO4 + S ¯ + 4H2O;
в) Ве + 2H2SO4 = ВеSO4 + SO2 + 2H2O.
2. Реакции с HNO3 идут с большим количеством вариантов, при этом чем активнее металл и разбавленнее кислота, тем сильнее восстанавливается HNO3. Могут идти несколько параллельных реакций; может также идти одновременно реакция взаимодействие металла с водой, в которой растворена кислота.
а) 8Na + 9HNO3 разб. = 8NaNO3 + NH3 + 3H2O;
(или Ва) (или NH4NO3)
б) 8Na + 10HNO3 конц. = 8NaNO3 + N2О + 5H2O;
(или Ва)
в) 3Ве + 8HNO3 разб. = 3Ве(NO3)2 + 2NО + 4H2O;
г) Ве + 4HNO3 конц. = Ве(NO3)2 + NО2 + 2H2O.
Некоторые соединения кальция
1. Карбид Са легко разлагается водой:
СаС2 + 2Н2О = Са(ОН)2¯ + С2Н2.
2. Известняк, мел, мрамор: СаСО3
 .
.
3. СаО – негашеная известь; реакция гашения:
СаО + Н2О ® Са(ОН)2.
4. Са(ОН)2 – гашеная известь;
Са(ОН)2, раствор – известковая вода;
Са(ОН)2, осадок – известковое молоко.
5. Реакция открытия СО2:
а) через известковую воду пропускают углекислый газ и выделяется осадок белого цвета:
Са(ОН)2 + СО2 = СаСО3¯ + Н2О;
б) при дальнейшем пропускании СО2 осадок растворяется, т.к. образуется растворимая кислая соль:
СаСО3¯ + СО2 + Н2О = Са(НСО3)2.
6. Жёсткость воды ( ) – совокупность свойств, обусловленная содержанием в воде ионов Са2+, Mg2+; её наличие приводит к ряду проблем:
) – совокупность свойств, обусловленная содержанием в воде ионов Са2+, Mg2+; её наличие приводит к ряду проблем:
а) на посуде и в паровых котлах образуется накипь;
б) стирка затруднена, т.к. плохо образуется пена;
в) пища утрачивает свой вкус.
Вопросы для закрепления материала:
1.Какой газ будет выделяться при взаимодействии перекиси водорода с перманганатом калия (в присутствии серной кислоты) – а)водород? б)кислород? в)двуокись серы?
2.Что получится при помещении металлического кальция в воду – а)мел? б)негашеная известь? в)известковое молоко?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 648; Нарушение авторских прав?; Мы поможем в написании вашей работы!