
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидриды
|
|
|
|
Химические свойства
Получение водорода
1.В лаборатории: Zn + 2HCI = ZnCI2 + H2
2.В промышленности:
а)конверсия водяного газа (при повышенной to):
С + Н2О = СО + H2 , СО + Н2О = СО2 + H2
б)конверсия метана (при повышенной to ): СН4 + 2Н2О = СО2 + 4H2
3)В экспедиции (для радиозондов): LiH + Н2О = LiОH + H2
1. В большинстве реакций водород – сильный восстановитель, но Н2 – не очень активен, а атомарный Н более реакционоспособен (Н2 - 2  ® 2Н+)
® 2Н+)
а) с галогенами реакции идут по-разному
Н2 + F2 Þ 2HF (со взрывом, при низкой температуре и в темноте);
 (реакция замещения, механизм свободно-радикальный);
(реакция замещения, механизм свободно-радикальный);
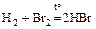 (идёт неполно);
(идёт неполно);
Н2 + J2 Û 2HJ.
б)  ;
;
г)  ;
;
д)  .
.
в) 3Н2 + N2 Û 2NH3;
2. Очень редко водород является окислителем (Н2 + 2  ® 2Н-)
® 2Н-)
2Li + H2 = 2LiH (гидрид).
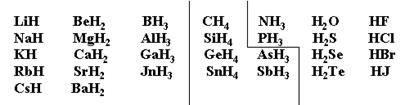

| Н-; ионные связи | Н- и Н+; связи близки к ковалентным неполярным | Н+; ковалентные полярные связи |
1) В зависимости от природы гидриды по-разному гидролизуются:
а) основной гидрид:  ;
;
б) кислотный гидрид:  .
.
2) Это сказывается и на реакциях комплексообразования
КН – основной гидрид;
AlH3 – амфотерный;
ВН3 – кислотный.
а) КН + ВН3 ® К[ВН4]
б) КН + AlН3 ® К[AlН4]
в) AlН3 + 3ВН3 ® Al[ВН4]3.
ВОДА (Н2О)
- составляет 50 – 90% любого живого существа; самое распространённое вещество планеты.
Многие физические константы воды приняты за эталон:
t°пл. = 0°С;
t°кип. = 100°С;
плотность = 1 г/см3;
теплоёмкость = 1  = 4,19
= 4,19  .
.
Валентные орбитали кислорода находятся в состоянии sр3-гибридизации, образуют искажённый тетраэдр, а молекула воды имеет угловую структуру:
угол НОН = 104°28¢  .
.
Поэтому молекулы Н2О очень полярны, что существенно сказывается на различных свойствах жидкой и твёрдой воды. Свойства обусловлены прежде всего структурой, образованием водородных связей (см. темы: химическая связь, электролитическая диссоциация, комплексные соединения). Жидкая и твердая вода существует в виде ассоциатов (Н2О)х.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 685; Нарушение авторских прав?; Мы поможем в написании вашей работы!