
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природа воды
|
|
|
|
Н2О – амфолит по этой теории, т.к. может отдавать и присоединять протоны:
а) 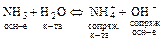 ;
;
б) 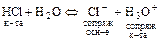 .
.
(Н3О+ - оксоний-ион).
При изучении поведения молекул чистой воды (например при выводе величины рН) можно записать Н2О Û Н+ + ОН-, а можно записать иначе:
 .
.
 .
.
Экспериментально установили, что в чистой воде при температуре 25°С соблюдается равенство: 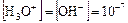 моль/л.
моль/л.
20 в. Г. Льюис предлагает ещё одну теорию кислот и оснований.
Кислота – это акцептор электронной пары
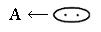
Основание – донор электронной пары
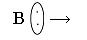
Реакция нейтрализации будет выглядеть:
А + В = АВ.
По этой теории:
1) расширяется круг привычных кислот; к ним также будут относиться ионы металлов (МеХ+); соединения бора (BCl3):
а) жёсткие кислоты(ж.к.) – это ионы щелочных, щелочно-земельных металлов и металлов с большим зарядом и маленьким радиусом (Li+, Ca2+, Al3+);
б) мягкие кислоты(м.к.) – тяжёлые ионы металлов с большим радиусом и малым зарядом (Cu+, Ag+, Hg2+).
2) Расширяется круг оснований; к ним относятся практически все лиганды и различные молекулы (NH3 или их производные):
а) жёсткие основания(ж.о.) – лиганды: F-, Cl-, Н2О, OH- и соединения R3N, NH3; поляризуются слабо;
б) мягкие основания (м.о.)– лиганды объёмные, хорошо поляризуются: S2-, HS-, RSH, SCN-, 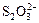 , CN-, J-.
, CN-, J-.
3) Наиболее прочные соединения образуются между:
а) жёсткими кислотами и жёсткими основаниями;
б) мягкими кислотами и мягкими основаниями.
Пример: 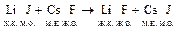 .
.
Становится понятно, почему реакция протекает в прямом направлении.
4) Однако эта теория имеет ограниченное применение, т.к. затруднена количественная оценка силы кислот и оснований. Если располагать основания по их силе в отношение одной кислоты, то получится один ряд, а если располагать эти же основания по отношению к другой кислоте, то получится другой ряд.
Электролитическая диссоциация гидроксидов; амфотерность
Характер диссоциации зависит от природы и полярности связей:
 ;
;
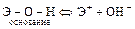 .
.
Если прочность связи О – Н и Э – О примерно равны, то гидроксид ЭОН может диссоциировать как по типу кислоты, так и по типу основания и будет называться амфотерным.
Пример: Рассмотрим равновесное состояние для свежевыпавшего осадка Zn(OH)2:
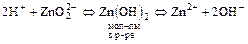
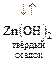
а) при добавлении кислоты равновесие по принципу Ле-Шателье сместится вправо (реализуется основной вариант амфолита)
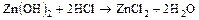
(в растворе существует ион Zn2+);
б) при добавлении щёлочи равновесие по принципу Ле-Шателье смещается влево и Zn(OH)2 ведёт себя как кислота

(в растворе существует ион 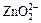 ).
).
Вопросы для закрепления материала:
1.Какие частицы можно считать кислотами по протолитической теории – CN‑, H3 О+, BCI3, NH4+, HCI, NH4С1?
2.Какие из них можно отнести к основаниям?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!