
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понижение давления насыщенных паров растворителя
|
|
|
|
Над любым растворителем в воздухе всегда находится какое-то количество газообразных молекул этого же растворителя. Чем выше температура, тем больше молекул растворителя в газообразном состоянии будет над раствором и соответственно давление паров растворителя (Р°) будет больше.
Если при этой же температуре измерить давление насыщенного пара растворителя уже над раствором какого-либо вещества (Р), то оно будет меньше. И всегда Р° > Р для любого растворителя.
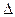 Р = (Р° - Р) – абсолютное понижение давления пара растворителя.
Р = (Р° - Р) – абсолютное понижение давления пара растворителя.
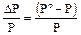 - относительное понижение давления пара растворителя.
- относительное понижение давления пара растворителя.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворённого вещества:
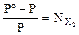 , где
, где  ;
;
n – число моль (х1 – растворитель; х2 – растворённое вещество).
Следствие 1: повышение температуры кипения раствора по сравнению с чистым растворителем прямопропорционально его моляльной концентрации (В).
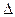 tкип = Е × В, где Е - эбулиоскопическая константа, величина табличная (различна у разных растворителей). Она показывает, на сколько градусов повысится температура кипения раствора с В = 1 моль/кг растворителя.
tкип = Е × В, где Е - эбулиоскопическая константа, величина табличная (различна у разных растворителей). Она показывает, на сколько градусов повысится температура кипения раствора с В = 1 моль/кг растворителя.
( град/моль/кг Н2О).
град/моль/кг Н2О).
 - моляльная концентрация.
- моляльная концентрация.
Следствие 2: понижение температуры замерзания раствора по сравнению с чистым растворителем прямопропорционально его моляльной концентрации:
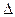 tзам = К × В, где К - криоскопическая константа, табличная величина
tзам = К × В, где К - криоскопическая константа, табличная величина
( град/моль/кг Н2О).
град/моль/кг Н2О).
Пример: При какой температуре закипит 50%-ный раствор сахарозы в воде?
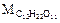 = 342 г/моль.
= 342 г/моль.
50% раствор: на 1000 г Н2О приходится 1000 г сахарозы;
в молях: 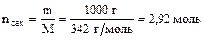 .
.
В = 2,92 моль/кг р-ля.
 .
.
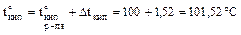 .
.
Ткип = 273 + 100 + 1,52 = 374,52 град К.
Для водных растворов изменение температур кипения и замерзания по сравнению с чистой Н2О можно отобразить так:

Вопросы для закрепления материала:
1.Чему равен изотонический коэффициент для AlC13 – 2, 3 или 4?
2.Почему варенье можно хранить зимой в стеклянных банках в неотапливаемом помещении?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 584; Нарушение авторских прав?; Мы поможем в написании вашей работы!