
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация
|
|
|
|
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток.
Электролитическая диссоциация - процесс распада электролитов на ионы под действием растворителя (происходит вследствие электростатического взаимодействия вещества с полярными молекулами растворителя).
I. Теорию создал С. Аррениус, и он рассматривал диссоциацию как механический распад; ввел понятия «катион» и «анион».
II.Дополнил теорию И.А. Каблуков, доказав, что диссоциация - физико-химический процесс. Полярные молекулы растворителя способствуют лучшей диссоциации, т. к. окружают ионы в растворе, образуя довольно устойчивые частицы: «сольваты». Если растворитель - Н2О, то частицы называются «гидраты», и иногда при испарении растворов эти захваченные молекулы воды остаются в кристаллической решетке.
Степень диссоциации (a) - количественная мера способности вещества распадаться на ионы (экспериментально ее можно определить, например, исследуя электропроводность растворов):
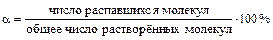 ,
,
a зависит от:
a) природы растворителя (чем он полярнее, тем a больше);
б)температуры (чем больше температура, тем a больше);
в)концентрации (чем меньше С, тем больше a);
г)от природы растворенных веществ.
По величине a все вещества можно поделить на 3 группы.
1. Сильные электролиты (a > 30%):
a) минеральные кислоты НС1, HBr, HI, HNO3, H2SO4, HCNS, HC1O4, HMnO4;
б) основания, образованные щелочными и щелочно-земельными металлами:
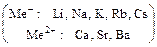
в)соли, помеченные в таблице растворимости буквой «р».
2. Слабые электролиты (a < 1-3%):
a) почти все органические кислоты;
б)минеральные кислоты H2S, Н2СОз, H2SiO3, HCN, Н2F2;
в)основания, образованные остальными металлами; NH4OH;
г)соли, помеченные в таблице растворимости буквами «м» и «н»;
д)Н2О
3. Средние электролиты (1 - 3% < a < 30%):
НСООН, HNO2, H2SO3, H3PO4, Mg(OH)2 и т. д.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 483; Нарушение авторских прав?; Мы поможем в написании вашей работы!