
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа равновесия
|
|
|
|
Характер диссоциации
Если кислота имеет несколько атомов Н, а основание - несколько групп ОН, то возможна ступенчатая диссоциация. Для слабых кислот и оснований наиболее вероятна диссоциация по 1 ступени и потому высока вероятность нахождения в растворе кислых и основных ионов. Соли же, как правило, диссоциируют сразу, в одну ступень.
Например:
а) 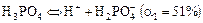 ;
;
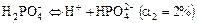 ;
;
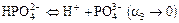
б) 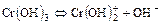 диссоциирует очень слабо;
диссоциирует очень слабо;
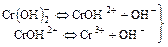 практически не идет;
практически не идет;
в) 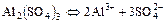 ;
;
г) 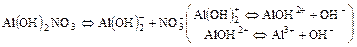 ;
;
д) 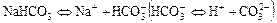 .
.
Вопросы для закрепления материала:
1.Какая из кислот будет самой слабой – а) сернистая? б)серная? в)сероводородная?
2.Написать уравнение диссоциации соли железо(Ш) диводородфосфат.
Введена для количественной оценки слабого электролита, зависит от:
а) природы растворителя;
б) природы растворённого вещества;
в) температуры.
1. Для слабых кислот её называют К кислоты (КА или Ка).
В случае ступенчатой диссоциации кислот она рассчитывается для каждой ступени.
Пример:
I ст. Н2S Û H+ + HS-
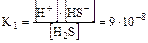
II ст. HS-Û Н+ + S2-

суммарный процесс: Н2S Û 2H+ + S2-
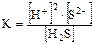 .
.
Для слабых и средних кислот:
а) К1 всегда максимальна (K1 > K2 > K3);
б) К = K1 × K2 × K3×…;
в) 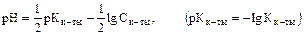 ,
,
т.е. среда раствора кислоты зависит от Кк-ты.
2. Для слабого основания также учитывают его ступенчатую диссоциацию и количественно оценивают через К основания (КВ или Кb).
Пример:
I ст. 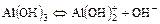
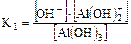
II ст. 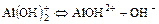

III ст. AlOH2+Û Al3+ + OH-
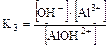 .
.
Для слабых и средних оснований:
а) K1 > K2 > K3
б)  .
.
Произведение растворимости (ПР)
Для насыщенных растворов солей имеет место равновесие между ионами, перешедшими в раствор и молекулами нерастворившейся соли
AgCl Û Ag+ + Cl-, 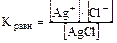 .
.
Т.к. для малорастворимых солей [соли] = const (т.е. [AgCl] = const), то Кравн [AgCl] = K’ = [Ag+] × [Cl-], т.е. в насыщенном растворе соли произведение концентраций ионов, находящихся в растворе, есть величина постоянная и называется «произведение растворимости» (ПР). Эта величина табличная, при расчётах следует учитывать, что размерность концентраций ионов солей - моль/л.
Для более сложных случаев учитывают индексы, имеющиеся в молекуле. Например: HgJ2 Û Hg2+ + 2J-
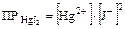
Для солей одинакового стехиометрического состава чем меньше величина ПР, тем менее растворима соль.
Если при действии какого-либо растворителя возможно выпадение из раствора нескольких осадков солей с однотипными химическими формулами, то они выпадают по правилу ПР: вначале выпадут в осадок менее растворимые соли, а затем более растворимые.
Пример: в растворе имеются соли NaCl, NaBr, NaJ; в качестве осадителя туда добавили раствор AgNO3. Последовательность выпадения осадков оцениваем по значению ПР:
ПР для AgCl = 1,7×10-10; для AgBr = 3,3×10-13; для AgJ = 8,5×10-17. Вначале выпадает в осадок AgJ, затем AgBr и последним AgCl.
Растворимость (Р)
Р – способность вещества растворяться в том или ином растворителе при данной температуре. Мерой растворимости вещества является концентрация его насыщенного раствора. Размерность может быть различной: г/л, моль/л, г/дм3, моль/дм3, г/см3, г/100 г Н2О.
Связь между Р и ПР
1. Для электролита с ионами одинаковой зарядности типа АВ (АВ Û А + В)
ПР = [A] × [B].
В растворе над осадком концентрацию молекул вещества можно принять равной концентрации образующихся из них ионов: [AB] = [A] = [B]. В то же время концентрация молекул вещества АВ над осадком равна растворимости осадка РАВ:
[AB] = РАВ
Тогда ПРАВ = [A] × [B] = РАВ × РАВ. Отсюда выводим 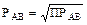
2. Для электролита, состоящего из ионов разной зарядности: AmBn Û mA + nB. Т.к. концентрация молекул этого вещества над его осадком равна растворимости вещества 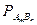 , то
, то 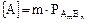 и
и 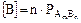 .
.
Тогда  ,
,
отсюда: 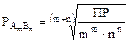 .
.
Пример:
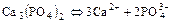 ,
,
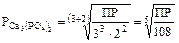 .
.
Диссоциация воды. Водородный показатель (рН)
Водородный показатель рН служит для количественного определения среды растворов. Его выводят, учитывая характер диссоциации чистой воды:
H2O Û H+ + OH-.
При температуре 22°С в чистой воде [Н+] = [ОН-] = 10-7 моль/л.
Отсюда 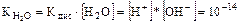 моль2/л2.
моль2/л2.
Равенство [Н+] × [ОН-] = 10-14 моль2/л2 справедливо не только для чистой воды, но также для растворов кислот, оснований и солей и не соблюдается в концентрированных кислотах и щелочах.
Понятие рН удобно в написании и произношении: величину находят по формуле
 .
.
Отсюда [Н+] = 10-рН.
Реже пользуются гидроксильным показателем: рОН = -lg[OH-]. Оба показа-теля связаны друг с другом равенством: рН + рОН =14.
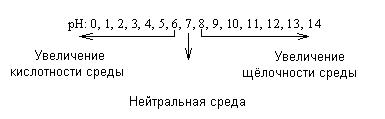
Для биологических жидкостей значения рН очень важны, и их отклонение от нормы говорит врачу о характере патологии (табл.4)
Таблица 4
Значение рН биологических систем
| Жидкости и ткани организма | рН (норма) |
| Сыворотка крови | 7,35 - 7,45 |
| Спинномозговая жидкость | 7,35 - 7,45 |
| Желчь в протоках | 7,4 - 7,45 |
| Желчь в пузыре | 5,4 - 6,9 |
| Слезы | 7,4 |
| Содержимое тонкого кишечника | 7,6 - 8,0 |
| Слюна | 6,35 - 6,85 |
| Желудочный сок | 0,9 -1,5 |
| Кожа | 6,2 - 7,5 |
| Моча | 4,8 - 7,5 |
| Фекалии | 7,0 - 7,5 |
Пример 1:
Определить рН раствора НС1 (диссоциацию считать полной), у которого
С = 0,01 моль/л.
Решение:
[Н+] = [НС1] = 10-2 моль/л,
отсюда
рН = -lg[H+] = -lg 10-2 = 2.
Пример 2:
Определить рН и рОН раствора КОН, если С = 0,1 моль/л.
Решение:
[ОН-] = [КОН] = 10-1 моль/л,
отсюда
pOH = - lg 10-1 = - (-1) =1, pH = 14 – pOH = 14 - l = 13.
Определение среды раствора
Для определения среды раствора, как правило, используют кислотно-основные индикаторы Оствальда: они представляют собой сложные органические кислоты или основания, у которых молекулы имеют одну окраску, а ионы - другую окраску и при добавлении индикаторов к исследуемому раствору, в соответствии с принципом Ле-Шателье, происходит смещение равновесия и раствор окрашивается в определенный цвет (табл.5).
Таблица 5
Кислотно-основные индикаторы
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный (рН<5) | Фиолетовый (рН:5-8) | Синий (рН>8) |
| Метилоранж | Розовый (рН<3,1) | Оранжевый (рН:3,1-4,4) | Желтый (рН>4,4) |
| Фенолфталеин | Бесцветный (рН< 8) | Бесцветный (рН: 8-10) | Малиновый (рН>10) |
С помощью универсальной лакмусовой бумаги можно измерять рН растворов с точностью до половины единицы (рН = Х ± 0,5). Современные приборы рН-метры измеряют значения рН до 0,001 единицы (рН = Х ± 0,001)
Закон разбавления Оствальда
Этот закон объединяет количественные характеристики a и Кравн..
Пусть для какого-то слабого электролита его частичная диссоциация запишется в виде
АВ Û А + В,
[АВ] исходная = С, тогда перед растворением вещества [А] = [В] = 0.
После установления равновесия в растворе концентрации станут следующими. Берём величину степени диссоциации не в %, а в долях и тогда доля распавшихся на ионы молекул будет a, а доля оставшихся целых молекул будет (1 - a), т.е. [АВ] оставшихся = С × (1 - a), тогда как [А] = [В] = a × С.
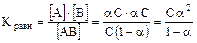 .
.
Для очень слабых электролитов a << 1, тогда условно приравняем (1 - a)» 1, отсюда Кравн..= С × a2 и следовательно
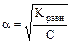 .
.
Из закона следует, что степень диссоциации вещества a будет возрастать при уменьшении С, т.е. при разбавлении раствора.
Для растворов сильных электролитов говорят о «кажущейся степени диссоциации». Каждый ион окружён ионной атмосферой из ионов противоположного заряда. Вместо понятия «концентрация» используют понятие «активность иона» (а) – это та условная концентрация, соответственно которой ион действует в химических реакциях.
а = f × c,
где f – коэффициент активности.
Если f ® 1, то а ® c и этот факт говорит о слабом межионном взаимо-действии. Эффект имеет место в очень разбавленных растворах сильных электролитов.
Вопросы для закрепления материала:
1.Определить рН раствора серной кислоты, у которого С = 0,005 моль/л.
2.Величина рН желудочного сока больного = 3. Какой кислотности это соответствует - повышенной или пониженной?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 557; Нарушение авторских прав?; Мы поможем в написании вашей работы!