
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмос, осмотическое давление
|
|
|
|
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Это свойства, которые зависят только от концентрации растворенного вещества:
а) осмотическое давление (Росм.);
б) понижение давления насыщенного пара над раствором;
в) изменение температуры кипения и температуры замерзания растворов по сравнению с чистым растворителем.
Эти свойства позволяют определять молярную массу растворённого вещества, его степень диссоциации и изучать физико-химические свойства биологических объектов.
Осмос – самопроизвольная односторонняя диффузия растворителя через полупроницаемую перегородку в сторону выравнивания концентраций.
Иногда бывает двусторонняя диффузия: молекулы растворителя и растворённого вещества движутся в противоположных направлениях, но такое явление встречается реже. Можно выделить два вида полупроницаемых перегородок (мембран):
1) природные – стенки клеток, оболочки глаза, плавательный пузырь рыб;
2) искусственные – целлофан.
Выравнивание концентрации – это процесс самопроизвольный; термодинамически разрешённый: S > 0, G < 0.
1877 г. Пфеффер установил для идеальных растворов, что Росм. прямопропорционально:
а) концентрации растворённого вещества;
б) абсолютной температуре.
1887 г. Вант-Гофф вывел закон: осмотическое давление раствора равно тому давлению, которое производило бы при данной температуре вещество, будучи в газообразном состоянии и занимая объём, равный объёму раствора.
Росм. = 1000 CRT,
где Росм. в Па;
R – универсальная газовая постоянная;
Т – температура, град. К;
С – моль/л.
или
Росм.= CRT, где Росм. в кПа.
Если учесть, что
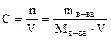 ,
,
то тогда
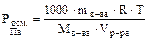 или
или 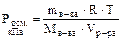 .
.
Этот закон выполняется для растворов неэлектролитов малых концентраций.
Пример: Найти молекулярную массу неэлектролита, если в 5 л раствора содержится 2,5 г вещества при температуре 20°С и Росм. = 2,3×104 Па.
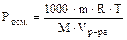 ; Т = 273 + t° = 293 К.
; Т = 273 + t° = 293 К.
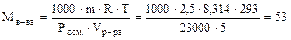 (г/моль).
(г/моль).
Изотонические растворы – растворы с одинаковым осмотическим давлением:
а) природные – кровь, лимфа, морская вода;
б) искусственные – физиологический раствор (0,9% NaCl), раствор глюкозы (5%).
Гипертонические растворы – растворы с высоким Росм. (10% NaCl).
Гипотонические растворы – растворы с низким Росм.
Тургор – осмотическое давление клеточного содержимого. Оно уравновешено эластичным напряжением клеточных стенок: Росм. внутри клетки больше Росм. во внеклеточной жидкости.
Плазмолиз – явление, связанное с погружением клетки в гипертонический раствор: клетка сморщивается, т.к. вода выходит из клетки.
Деплазмолиз - клетка в гипотоническом растворе: она разбухает, т.к. молекулы воды через мембрану идут внутрь клетки.
Пример: Осмотическое давление крови в норме 7,4 – 7,8 атмосферы (С» 0,3 моль/л). Снижение концентрации веществ в плазме крови ведёт к понижению Росм. до 3,6 – 4 атм, что в свою очередь приводит к гемолизу. Полный гемолиз наступает при Росм. = 3 атм: клетки начинают лопаться.
Изотонический коэффициент (i)
- его вводят, когда изучают Росм. для растворов сильных электролитов, он учитывает распад электролита на ионы при растворении с учётом его степени диссоциации. Находят экспериментально:
а) для соли типа NaCl i = 1 + a (т.е. i ® 2);
б) для соли типа CaCl2 i = 2 + a (т.е. i ® 3);
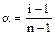 ,
,
где n – число ионов, на которые распадаются молекулы соли. Для таких растворов
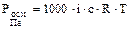 .
.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 556; Нарушение авторских прав?; Мы поможем в написании вашей работы!