
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атома
|
|
|
|
ОСНОВНІ ПОНЯТТЯ
Закони
Хімічних елементів Д.І. Менделєєва
Періодичний закон і періодична система
ОСНОВНІ ПОНЯТТЯ
Періодична система – це природна система хімічних елементів, що є графічним зображенням періодичного закону. Вона складається із семи періодів і восьми груп. Перший повний варіант періодичної системи був опублікований у 1871 році.
Період – це горизонтальний ряд хімічних елементів, розташованих за зростанням заряду атомних ядер, що починається лужним металом (перший – Гідрогеном) і закінчується інертним газом. Періоди поділяються на малі (І-ІІІ) і великі (IV-VII).
Малий ряд – це період, що складається з одного ряду хімічних елементів, у межах якого властивості хімічних елементів змінюються від типових металів через амфотерні елементи до неметалів (у першому періоді – тільки неметали).
Великий ряд – це період, що складається з двох рядів хімічних елементів – парного і непарного.
Парний ряд – ряд великого періоду, що складається тільки з металів, як типових, так і амфотерних.
Непарний ряд – ряд великого періоду, в якому спочатку розташовуються типові метали, потім амфотерні елементи і нарешті неметали.
Група – це вертикальний ряд хімічних елементів, об’єднаних за ознакою валентності. Група поділяється на головну та побічну підгрупи.
Головна підгрупа – це вертикальний ряд хімічних елементів, що розташовуються як у малих, так і великих періодах (елементи s -родини або (і) p -родини).
Побічна підгрупа – це вертикальний ряд хімічних елементів, що розташовуються виключно у великих періодах (елементи d –родини або (і) f -родини).
Періодичний закон (класичне формулювання, Д.І. Менделєєв – 1 березня (17 лютого) 1869 р.): властивості простих тіл, а також форми та властивості їх сполук перебувають у періодичній залежності від величини атомних ваг елементів.
(Під терміном „просте тіло” мається на увазі хімічний елемент, а під терміном „атомна вага” – атомна маса).
Періодичний закон (сучасне формулювання): властивості хімічних елементів, а також їхніх сполук перебувають у періодичній залежності від величини заряду атомних ядер, тобто порядкових номерів елементів.
Періодичний закон (сучасне хімічне формулювання): властивості хімічних елементів, а також їхніх сполук періодично повторюються, тому що періодично повторюється електронна будова зовнішнього (останнього) енергетичного рівня, тобто його електронна конфігурація.
Атом – це нейтральна електронно-ядерна система, що складається з позитивно зарядженого ядра і негативно зарядженої електронної оболонки, заповненої електронами, кількість яких дорівнює атомному (порядковому) номеру хімічного елемента. Ядро атома складається з протонів й нейтронів, а електронна оболонка – з енергетичних рівнів і підрівнів.
Протон – елементарна позитивно заряджена частинка, що входить до складу ядра атома. Позначається р+. Відкритий Е. Резерфордом (Англія) у 1920 р.
Нейрон – елементарна нейтральна частинка, що входить до складу ядра атома. Позначається n0. Відкрита Дж. Чедвіком (Англія) у 1932 р.
Нуклони – це протони та нейтрони ядра атома, зв’язані між собою ядерними силами.
Нуклід – вид атома хімічного елемента з певним значенням масового числа, тобто суми чисел протонів і нейтронів у ядрі.
Наприклад: нуклід Гідроген-1 позначають 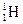 (тобто атом Гідрогену, в ядрі якого міститься один протон), нуклід Гідроген-2 -
(тобто атом Гідрогену, в ядрі якого міститься один протон), нуклід Гідроген-2 - 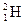 (тобто атом Гідрогену, в ядрі якого міститься один протон і один нейтрон).
(тобто атом Гідрогену, в ядрі якого міститься один протон і один нейтрон).
Сьогодні відомо понад 2500 нуклідів.
Масове число ядра атомів – це ціле число, що дорівнює сумі протонів і нейтронів у ядрі певного атома.
Позначається А.
Електрон - найдрібніша елементарна негативно заряджена частинка, що входить до складу електронної оболонки атома. Позначається е-. Відкритий Дж. Том соном (Англія) і Е. Віхертом (Німеччина) у 1897 р.
Валентні електрони – це електрони останнього енергетичного рівня, що беруть участь або здатні брати участь в утворенні хімічних зв’язків.
Електронна конфігурація атома – це розподіл електронів в електронній оболонці атома по енергетичних рівнях і підрівнях.
Електронна орбіталь – ділянка простору, де перебування електрона, за його обертання навколо ядра атома, найбільш імовірне і максимальне.
Існують:
s -орбіталь - має форму кулі;
р -орбіталь - має форму гантелі або витягнутої вісімки;
d -орбіталь - має форму квітки;
f -орбіталь - має форму складної квітки.
На будь-якій орбіта лі не може існувати більш ніж два електрони з протилежними спінами.
Спін (від англ. spin – «крутитися», «обертатися») електрона – обертання електрона навколо власної осі під час руху навколо ядра атома. Буває позитивним і негативним.
Позитивний спін електрон – це обертання електрона за годинниковою стрілкою навколо власної осі. Позначається ↑.
Негативний спін електрона – це обертання електрона проти годинникової стрілки навколо власної осі. Позначається ↓.
Фізичний зміст атомного (порядкового) номера: атомний (порядковий) номер хімічного елемента показує заряд ядра атома, тобто кількість протонів у ядрі, а оскільки атом електронейтральний, то і кількість електронів у електронній оболонці атома.
Фізичний зміст номера періоду: номер періоду показує кількість енергетичних рівнів (електронних шарів) у електронній оболонці атома певного хімічного елемента.
Фізичний зміст номера групи: номер групи показує:
a) кількість валентних електронів в електронної оболонці атома хімічного елемента;
б) вищу валентність хімічного елемента, що знаходиться в головній підгрупі, винятки – Флор, Оксиген, Нітроген.
Хімічний елемент – це визначений вид атомів, що мають одинаків позитивний заряд ядра (що дорівнює числу протонів у ядрі) і притаманну тільки їм сукупність властивостей.
Ізотопи (від грецьк. isos – „рівний”, „однаковий” і topos – „місце”) – різновиди атомів того самого хімічного елемента, що мають однаковий позитивний заряд ядра, але різну атомну масу через різне число нейтронів у ядрі. Цей термін використовується тільки в множині.
s-родина – це родина хімічних елементів, у яких на останньому енергетичному рівні елетрони заповнюють s-підрівень (одну s-орбіталь). Цю родину утворюють s-елементи, тобто елементи І та ІІ головних підгруп і Гелій.
р-родина – це родина хімічних елементів, у яких на останньому енергетичному рівні електрони заповнюють р -підрівень (три р -орбіталі). Цю родину утворюють р -елементи, тобто елементи ІІІ-VІІІ головних підгруп, крім Гелію.
d-родина – це родина хімічних елементів, у яких на передостанньому енергетичному рівні електрони заповнюють d -підрівень (п’ять d -орбіталей). Цю родину утворюють d -елементи, тобто елементи всіх побічних підгруп, крім лантаноїдів і актиноїдів.
f-родина – це родина хімічних елементів, у яких на передостанньому енергетичному рівні електрони заповнюють f -підрівень (сім f -орбіталей). Цю родину утворюють f -елементи, тобто лантаноїди й актиноїди.
Квантові числа – це чисельні характеристики електрона в атомі, що описують рівень енергії електрона, форму електронної хмарини та інші його властивості.
Існують:
n – головне квантове число;
l – орбітальне (побічне) квантове число;
m – магнітне квантове число;
ms - спінове квантове число.
Радіоактивні елементи – це хімічні елементи, що мають радіоактивність.
Радіоактивність – це довільне випромінювання заряджених частинок нестійких ядер атомів, що призводить до його руйнування (розпаду).
Ядерна реакція – це процес перетворення атомів одного хімічного елемента на атоми інших хімічних елементів у результаті зміни будови ядра атома. Бувають ланцюговими та не ланцюговими.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3196; Нарушение авторских прав?; Мы поможем в написании вашей работы!