
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахункові формули
|
|
|
|
ЗАКОНИ
Принцип найменшої енергії: у незбудженому (нормальному, чи основному) стані атома електрони розташовуються так, щоб енергія атома була мінімальною.
Принцип (заборона) Паулі (Швейцарія, 1925 р.): в одному атомі не може бути двох електронів з однаковим набором чотирьох квантових чисел (головного, орбітального, магнітного та спінового).
Правило Клечковського (СРСР, 1951 р.): у незбудженому стані атома електрони займають підрівень з мінімальним значенням суми головного (n) і орбітального (l) квантових чисел, тобто m + l. Якщо значення суми квантових чисел однакові, то спочатку заповнюється підрівень з мінімальним значенням головного квантового числа (n).
Наприклад: у підрівнів 3 p (3 + l) і 4 s (4 + 0) сума головного й орбітального квантових чисел однакові і дорівнює 4, Але першим буде заповнюватися підрівень 3 p, тому в 4 s - 4.
Принцип Хунда (Німеччина, 1927 р.): електрони в межах одного підрівня розташовуються по окремих орбіта лях так, щоб сумарний спін був максимальним.
1. Формула обчислення числа протонів (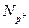 ) у ядрі й числа електронів (
) у ядрі й числа електронів ( ) на електронній оболонці:
) на електронній оболонці:
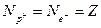 ,
,
де Z – атомний (порядковий) номер хімічного елемента.
2. Формула обчислення числа нейтронів ( ) у ядрі:
) у ядрі:
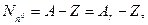
де А – масове число ядра атома, що приблизно дорівнює відносній атомній масі (Аr).
3. Формула обчислення максимального числа електронів на енергетичному рівні:
N=2n2,
де n – номер енергетичного рівня (головне квантове число);
n2 – максимальне число орбіта лей не енергетичному рівні.
4. Формула обчислення середньої відносної атомної маси природних ізотопів:
Ar(E)=A1 .W1 + A2 .W2 + A3 . W3 +...,
де А1, А2, А3 - маси ізотопів;
W1, W2, W3 - масові частки ізотопів у природі.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 386; Нарушение авторских прав?; Мы поможем в написании вашей работы!