
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цинк оксид (Zinci oхуdum ) ( ДФУ )
|
|
|
|
MgO
План
II групи
1. Лікарські речовини, що містять магній: (магнію оксид легкий, магнію сульфат гептагідрат, магнію карбонат).
2. Лікарські речовини, що містять кальцій: (кальцію хлорид дигідрат, кальцію хлорид гексагідрат).
3. Лікарські речовини, що містять барій: (барію сульфат).
4. Лікарські речовини, що містять цинк: (цинку оксид, цинку сульфат гептагідрат).
5. Лікарські речовини, що містять ртуть: (ртуті хлорид, ртуті оксид жовтий).
Лікарські речовини, що містять магній
У природі магній зустрічається у вигляді мінералів: доломіт (Мg СОз * CаСОз), магyеит (MgCO3 , тальк (3MgO*4SiO2 *H2O). Солі магнію міститься також в грунті, природних водах, особливо в морській воді і мінеральних джерелах.
Магнія оксид легкий (Magnesii oxydum leve) (ДФУ)
Магнія оксид важкий (Magnesii oxydum ponderosum) (ДФУ)
Отримання.
1) Прожарювання основного карбонату натрію при 250 ° -350 ° С:
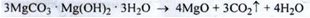
Якщо прожарювання проводити при 900-1000 ° С, то виходить «легкий» порошок.
2) При обробці природних розсолів кальцію гідроксидом (вапняним молоком).

Утворення магнію гідроксид переводять у оксид термічною обробкою:
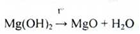
Властивості. Дрібний, аморфний порошок білого кольору. Практично не розчинний у воді, в якій проявляє лужну реакцію по фенолфталеїну. Розчинний в розведених мінеральних кислотах зі слабким виділенням бульбашок газу.
Насипний об’єм: 15.0 г магнію оксиду легкого займає обсяг близько 150мл.
15.0 г магнію оксиду важкого займає обсяг близько 30мл.
Ідентифікація. Встановлюється після розчинення субстанції в кислоті азотної (ДФУ):

надлишок кислоти азотної нейтралізують гідроксидом натрію.
1. Реакція на Mg2+ (ДФУ).
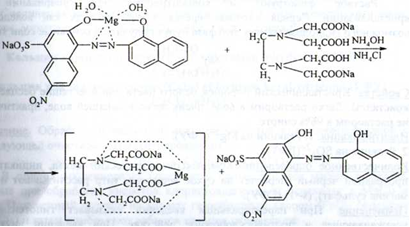
2. Для ідентифікації іона магнію можна використовувати 8 - оксихінолін, який з іоном магнію в середовищі аміачного буфера утворює жовто -зелений кристалічний осад, а при додаванні органічних розчинників (хлороформ, бутіламіна та ін) - жовто - зелене забарвлення органічного шару (дана реакція використовується при визначенні магнію як домішкa):
|
|
|
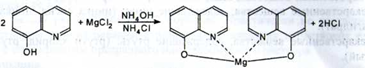
Кількісне визначення.
1. Комплексонометрія в присутності аміачного буферного розчину (після розчинення субстанції в кислоті хлористоводневої); точка еквівалентності встановлюється за допомогою індикаторного суміші протравного чорного; перерахунок на суху речовину, метод піпетування, (s = 1) (ДФУ):
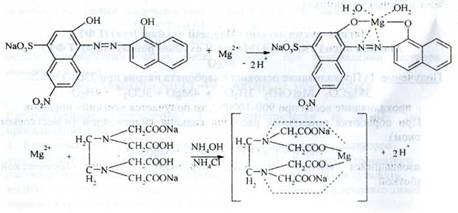
У точці еквівалентності, надлишкова крапля титранту взаємодіє з комплексом металу і індикатора:
2. Ацидиметрія, зворотне титрування. Наважку магнію оксиду розчиняють у надлишку 1М розчину кислоти хлористоводневої, надлишок кислоти відтитровують I М розчином натрію гідроксиду в присутності метилового орінженого; (s=1/2):
Застосування. Антацедний засіб при підвищеній кислотності шлункового соку (при гастритах, виразковій хворобі шлунка і дванадцятипалої кишки). Нейтралізуючи кислоту хлористоводневу шлункового соку, перетворюється на магнію хлорид, який надає послаблювальну дію. Застосовується також при отруєнні кислотами.
Магнію оксид входить до складу препарату " Альмагель " і протиотрути при отруєнні миш'яком.
Зберігання. У добре закупореній тарі, так як магнію оксид взаємодіє із вуглекислим газом і вологою, які містяться в повітрі, утворюючи магнію карбонат і гідроксид:
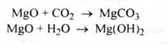
Магнію сульфат гептагідрат
(Magnesii sulfas heptahydricus) (ДФУ)
Отримання. Розчиненням магнезиту в надлишку розведеної кислоти сірчаної:
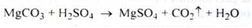
Розчин фільтрують і концентрують при паруванні до кристалізації. Сірчана кислота береться у надлишку, тому що внаслідок можливого гідролізу магнію сульфату будуть виходити основні солі типу:
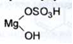
Властивості. Кристалічний порошок білого кольору або блискучі безбарвні кристали. Легко розчинний у воді, дуже легко в киплячій воді, практично не розчинний у 96 % спирті.
|
|
|
Ідентифікація.
1. Реакції на Mg2 + (rФУ).
2. Реакція на SO4- (ДФУ).
Кількісне визначення. Комплексонометричний метод, індикатор - уїдливий чорний (перерахунок на суху речовину, титр розраховують на б / в магнія сульфат), (s = 1) (ДФУ)
Застосування. При парентеральному введенні надає гіпотензивну, заспокійливу і проти судомну дію. При введенні всередину - жовчогінний і послаблюючу дію.
Зберігання. У добре закупореній тарі.
Магнію карбонат легкий (Мagnesii subcarbonas levis) (ДФУ)
Магнію карбонат важкий (Мagnesii subcarbonas ponderosus) (ДФУ)
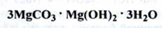
Отримання.
1. Взаємодія розчинів магнію сульфату і натрію карбонату при 70-80 ° С:
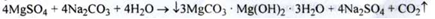
2. З магнію гідрокарбонату нагріванням до 40-50 ° С:

Властивості. Порошки білого кольору. Практично не розчинні у воді. Розчиняються у розведених мінеральних кислотах з бурхливим виділенням бульбашок газу.
Ідентифікація.
1. Для магнію карбонату легкого насипний об'єм 15 г субстанції повинен бути близько 180 мл, для важкого - близько 30 мл (ДФУ).
2. Реакції на карбонати (а, Ь, с) (ДФУ).
3. 3. Реакція на Mg 2+, після розчинення в кислоті азотної і нейтралізації надлишку кислоти натріэи гідроксидом (ДФУ).
Кількісне визначення. Комплексонометрія (індикатор - уїдливий чорний) після розчинення субстанції в кислоті хлористоводневої. Розрахунок ведуть на магнію оксид
(40-45 %), (s = 1). (ДФУ).
Застосування. В’яжучий і антацидний засіб.
Зберігання. У добре закупореній тарі.
Лікарські речовини, що містять кальцій
З'єднання кальцію зустрічаються в природі у вигляді вапняку і крейди, мармуру, мінералів - гіпсу (CaS04 • 2Н20) і флюорита (CaF2).
Кальцію хлорид дигідрат (Calcii chloridum dihydricum) (ДФУ)
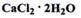
Кальцію хлорид гексагідрат (СаІсі chloridum hexahydricum) (ДФУ)
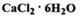
Отримання. Обробкою крейди або мармуру кислотою хлористоводневою з подальшим очищенням і концентруванням:

У природних мінералах містяться домішки іонів магнію і заліза, які при обробці кислотою хлористоводневою переходять у MgCl2 і FeCl2. Отриманий розчин насичують газоподібним хлором (FeCl2 окислюють до FeCl3) і потім додають надлишок кальцію гідроксиду:

Розчин збагачується кальцієм хлоридом, а домішки випадають в осад, який фільтрують. Надлишок кальцію гідроксиду переводять у кальцій хлорид, діючи кислотою хлористоводневою:
|
|
|

Властивості. Кристалічна маса білого кольору або білі кристали.
CaCl2•6H2O гігроскопічний. СаСI2 * 2Н20 - легко розчинний у воді, розчинний в 96 % спирті; СаСl2 • 6Н20 - дуже легко розчинний у воді, легко розчинний в 96 % спирті, замерзає при t ° = 29С °.
Індентифікація.
1. Реакція (а) на СІ- (ДФУ).
2. Реакції на Са2+ (a, b, c, d) (ДФУ).
3. Субстанція повинна витримувати вимоги розділу «Кількісне визначення» (ДФУ).
Кількісне визначення. Комплексонометрія в присутності індикатора калькокарбонової кислоти і розчину натрія гідроксиду концентрованого; (s = 1):
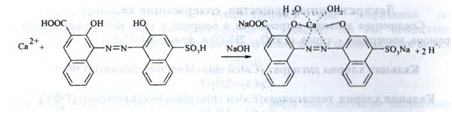
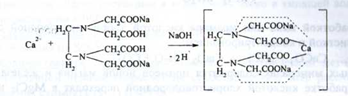
В точці еквівалентності:
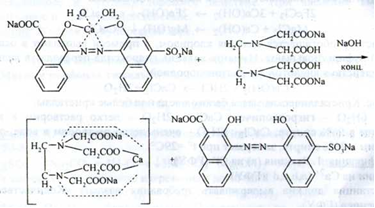
Застосування. При посиленому виведенні кальцію з організму, при алергічних захворюваннях спільно з протигістамінними препаратами, як засіб, що зменшує проникність судин, як кровоспинний засіб, як протиотрута при отруєнні солями магнію.
Зберігання. У повітронепроникному контейнері.
Лікарські речовини, що містять барій
У природі барій зустрічається у вигляді мінералів: ВаS04 - барiт; ВаСОз - вітерит. З солей барію в медицині застосовується барію сульфат, який не розчинний ні у воді, ні в кислотах, ні в лугах, тому не отруйний на відміну від розчинних солей барію, що володіють високою токсичністю.
Барію сульфат (Barii sulfas) (ДФУ)

Отримання. Для отримання субстанції мінерали - барит або вітерит переводять в розчинну сіль - барію хлорид:

Потім водний розчин хлориду барію обробляють водним розчином натрію сульфату або кислоти сірчаної:

Щоб барію сульфат вийшов дрібнодисперсний, розчини повинні бути, дуже розбавлені, і при цьому необхідно додавати який-небудь i слизистий відвар, який грає роль захисного колоїду (наприклад, лляну слизь).
Властивості. Дрібний, важкий порошок білого кольору, вільний від великих частин. Практично не розчинний у воді і органічних розчинниках, дуже мало розчинний у кислотах і розчинах гідроксидів лужних металів.
Ідентифікація.
1. Встановлюють після кип'ятіння препарату з натрієм карбонатом (ДФУ):
|
|
|

На фільтрат діють барій хлоридом у присутності кислоти хлористоводневої; виділяється білий осад (сульфат - іон):

2. Залишок, отриманий у попередньому випробуванні, розчиняють у кислоті хлористоводневій і до фільтрату додають кислоту сірчану: виділяється білий осад барію сульфату (іон барію) (ДФУ):

Випробування на чистоту. Так як барію сульфат застосовується внутрішньо у великих дозах (50-100 г на прийом), монографія висуває суворі вимоги до чистоти субстанції. регламентуються:
Килотність і лужність,
Речовини, розчинні в кислоті: визначають сухий залишок після
розчинення субстанції в кислоті оцтової та упарювання;
Окислюючі сполуки сірки - по реакції з калію йодидом і калію йодатом і присутності крохмалю:

(реакція проводиться у присутності калію йодиду, так як виділяється йод не розчинний у воді). Синє забарвлення випробуваного розчину має бути інтенсивніше забарвлення еталона, приготованого паралельно і аналогічно, але без додавання калію йодату.
Розчинні солі барію - з кислотою сірчаною розведеною. Через 1 ч. опалесценція отриманого розчину не повинна перевищувати опалесценцію суміші 10 мл розчину S і 1 мл води дистильованої.
Фосфати, миш'як, важкі метали.
Для підтвердження доброякісності проводять визначення седиментації субстанції.
Кількісне визначення. Не проводять.
Застосування. Рентгеноконтрастний засіб. Відпускається препарат тільки у фабричній упаковці по 100 г.
Зберігання. У щільно закритих подвійних паперових пакетах (внутрішній пакет повинен бути з пергаментного паперу), причому окремо від карбонатів щоб уникнути утворення навіть слідів барію карбонату.
Лікарські речовини, що містять цинк
Цинк поширений в природі у вигляді мінералів: цинкової обманки ZnS; цинкового шпату ZnСОз; каламіна 
Застосування сполук цинку в медицині засноване на тому, що цинк утворює сполуки з білками - альбумінатa. Розчинні альбумінати можуть надавати слабку в'яжучу або припікаючу дію; нерозчинні утворюють плівку на поверхні рани і сприяють загоєнню ран.
Встановлено, що цинк є синергетиком вітамінів, тобто сприяє прояву їх дії.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1381; Нарушение авторских прав?; Мы поможем в написании вашей работы!