
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коларгол ( Соllargolum)
|
|
|
|
План
HgO
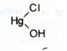
Отримання. Взаємодією розчинів ртуті (II) хлориду і натрію гідроксиду:

Для отримання субстанції, яка не містить сторонніх домішок, розчин ртуті (II) хлориду додають до розчину натрію гідроксиду, а не навпаки, щоб уникнути утворення основної солі -
Ртуті оксид залежно від способа її отримання може бути жовтого або червоного кольору. Колір залежить від ступеня дисперсності отриманого оксиду: дрібнодисперсна ртуть оксид жовтого кольору, крупно дисперсна - червоного. Червоний ртуті оксид в медицині не застосовується.
Властивості. Жовтий або оранжево -жовтий, важкий, тонкий, аморфний порошок без запаху. На світлі поступово темніє.
Розчинність. Субстанція практично не розчинна у воді, спирті, легко розчинній в розведених хлористоводневій, азотної і оцтової кислотах.
Ідентифікація. Встановлюють після розчинення в кислоті хлористоводневої:

по реакції на іон ртуті (II): при дії калію йодиду виділяється червоний осад, розчинний в надлишку реактиву:
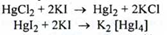
Специфічна домішка - сполуки ртуті (I) - відкривають кислотою хлористоводневою:

Кількісне визначення. Непряма ацидиметрія. Наважку розчиняють у воді, що містить надлишок калію йодиду. Виділився калій гідроксид титрують розчином кислоти хлористоводневої у присутності індикатора метилового червоного; (s = 1/ 2):
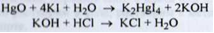
Застосування: Зовнішній антисептичний засіб для приготування очних мазей.
Зберігання. З обережністю (сильнодіючий), в добре закупореній тарі з темного скла, так як на світлі може утворюватися ртуть (І) оксид, що виявляється по потемнінню субстанції.
Ртуті оксиціанід (Нуdrargyri oxycyanidum)

Властивості. Білий або злегка жовтуватий порошок. Важко розчинний у воді. Повні розчини мають лужну реакцію.
Ідентифікація. До розчину субстанції при нагріванні додають калію йодид, заліза (II) сульфат, потім заліза (III) хлорид. При підкисленні кислотою хлористоводневою з'являється червоний осад (НgI2). При додаванні калію йодиду червоний осад зникає, і з'являється синій осад берлінської блакиті.
Кількісне визначення. Ртуть оксид - aацидиметрія, індикатор - метиловий оранжевий (s = 1/ 2):

Cубстанція. повинна містити не менше 45% HgО.
До відтитрованної рідини додають калію йодид і непрямої ацидиметрія визначають ртуті ціанід; (s = 1/ 2):

У субстанції має бути 53,3 % Hg(CN)2.
Застосування. Зовнішній антисептичний засіб.
Зберігання. У добре укупоренних банках оранжевого скла.
Лікарські речовини, що містять елементи
I і VIII груп періодичної системи Д.І. Менделєєва
1. Лікарські речовини, що містять мідь (мідь сульфат пентагідрат).
2. Лікарські речовини, що містять срібло (срібла нітрат, колларгол, протаргол).
3. Лікарські речовини, що містять залізо (заліза (II) сульфату пента - гідрат).
Міді сульфат пентагідрат
(Cupri sulfas pentahydricus) (ДФУ)

Отримання. Розчиненням чистої міді в кислоті сірчаної концентрованої:

Розчин випаровують(видаляють), і з розчину кристалізується 
Властивості. Кристалічний порошок синього кольору або прозорі сині кристали. Дуже легко розчинний у воді, розчинний у метанолі, практично не розчинний у 96 % спирті.
Ідентифікація
1. Іон міді ідентифікують за реакцією з розчином аміаку з утворенням синього осаду основної солі:

Основна сіль розчиняється в надлишку реактиву з утворенням аміачного комплексу темно -синього кольору (ДФУ):
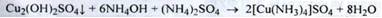
2. При додаванні до водного розчину субстанції розчину барію хлориду в присутності розведеної HCI утворюється білий осад (ДФУ):
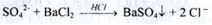
3. Субстанція повинна витримувати вимоги розділу «Втрата в масі при висушуванні» (ДФУ).
4. Водний розчин (1:20) препарату при зіткненні з залізом покриває його червоним нальотом металевої міді:
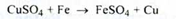
5. При взаємодії розчину міді сульфату з розчином Na2S утворює ться чорний осад:

Mідь сульфід (CuS) розчинний в кислоті азотної з виділенням сірки:

6. При дії на розчин міді сульфату, калію ферроцианида утворюється червоно -коричневий осад, розчинний у розчині аміаку.

міді ферроцианид
7. Характерною реакцією на іон міді є взаємодія з многоатомними спиртами і окси кислотами (гліцерин, глюконова кислота і т.д.) з утворенням забарвлених сполук.
Випробування на чистоту. Проводять визначення прозорості розчину, домішок хлоридів, заліза, свинцю, (атомно - адсорбційна спектроскопія), втрати в масі при висушуванні, залишкових кількостей органічних розчинників.
Кількісне визначення. Замісна йодометрія, титр ант - 0,1 М Na2S2O3, індикатор - крохмаль, (s = 1), (ДФУ):
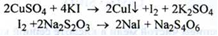
Застосування. Антисептичне, в'яжуче, припікаюче.
Зберігання. У добре закупореній тарі.
Срібла нітрат (Argenti nitras) (ДФУ)

Отримання. Розчиненням мідно - срібного сплаву в азотній кислоті при нагріванні:
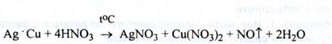
Властивості. Кристалічний порошок білого кольору або прозорі безбарвні кристали. Дуже легко розчинний у воді, розчинний у 96 % спирті.
Ідентифікація.
1. Реакції на нітрати (а, в) (ДФУ):
2. При дії на субстанцію кислотою хлористоводневою, утворюється білий осад, розчинний у розчині аміаку (ДФУ):

3. Реакція срібного дзеркала:

4. Реакція з дифеніламіном (N03-).
Випробування на чистоту. Проводять визначення прозорості, кольоровості, розчинності, кислотності або лужності.
Сторонні солі. Після реакції з кислотою хлористоводневою, розчин фільтрують, фільтрат упарюють досуха і визначають масу сухого залишку (не більше 2мг або 0,3 %).

Алюміній, свинець, мідь і вісмут. Субстанцію розчиняють в суміші розчину аміаку концентрованого і води. Розчин повинен бути прозорим (2.2.1) і безбарвним (2.2.2) (метод II).
Кількісне визначення. Тіоціанатометрія; індикатор - заліза (III) амонію сульфат (ДФУ):

Титрування проводять в середовищі кислоти азотної розведеної до червоно - жовтого фарбування; (s = 1).
Застосування. Антисептичний, припікаючий засіб.
Зберігання. У неметалічному контейнері, у захищеному від світла місці.
Колоїдні препарати срібла
(коларгол, протаргол)
Вихідними продуктами отримання колоїдних препаратів є білки (яєчний білок або казеїн) і срібла нітрат. Після обробки білка водяним паром або розчинами кислот або лугів утворюються лізальбінова і протальбінова кислоти, які мають відновні властивості. При дії на AgNO3 натрію гідроксиду утворюється срібла оксид:

Очищений срібла оксид (Ag20) змішують з розчином натрію лізальбіна або натрію протальбіната. У результаті відновлюється срібло (Ag), який в колоїдному вигляді зв'язується з білком.
Коларгол містить не менше 70 % срібла.
Протаргол містить 8 % Аg і 92% натрію лізальбінату або протальбіната.
Властивості. Зеленувато - або синювато -чорні пластинки з металевим блиском, розчинний у воді з утворенням колоїдного розчину.
Ідентифікація.
1. При нагріванні препарату відбувається обвуглювання і утворюється запах паленого рога.
2. Після оголення препарат розчиняють в  і фільтрують. При додаванні
і фільтрують. При додаванні
до фільтрату НСl утворюється осад. 

3. Біуретова реакція (див. гідроперит).
4. Відмінність від протарголу: золь препарату (1:50) після додавання розбавленої кислоти хлористоводневої утворює темно - бурий осад серебро лізальбінової кислоти. При додаванні лугу знову утворюється золь.
Кількісне визначення. Препарат мінералізують в колбі Кельдаля конц. сірчаною та азотною кислотою протягом 15 хв. Визначення проводять тіоціанатометрично методом (див. срібла нітрат). Вміст срібла не менше 70 %.
Для спрощення титр срібла перераховують на коларгол за формулою:

Зміст коларголу у відсотках (X) розраховують за формулою:
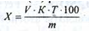
Застосування. У медицині застосовують розчин коларголу 1%, 2% і 3% екстемпорального приготування.
Зберігання. У добре укупоренних склянках темного скла, в захищеному від світла місці.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2197; Нарушение авторских прав?; Мы поможем в написании вашей работы!