
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конфигурационное взаимодействие
После вычисления электронной энергии молекулы по описанной выше методике, к ней добавляют энергию отталкивания ядер:
E полн = E эл + e 2/ r ab
Эта полная энергия зависит от межъядерного расстояния примерно так же, как и в методе ВС:
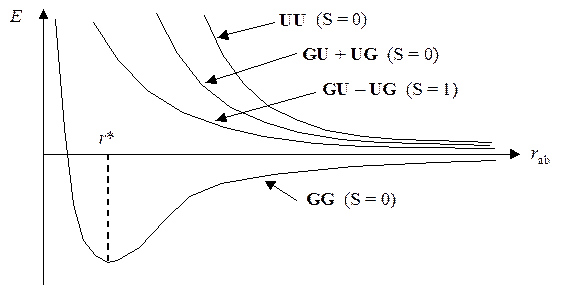
Располагая такой зависимостью, можно оценить равновесное расстояние между ядрами r* (длину химической связи) и энергию образования молекулы из атомов (прочность химической связи). Сравнение этих расчетных величин с соответствующими экспериментальными значениями показывает весьма сильные различия: r* эксп < r* расч и D E эксп > D E расч.
Эти расхождения можно в значительной мере исправить, если применить специальный прием — учесть т.н. конфигурационное взаимодействие (КВ). Разновидность метода МО, в которой такой учет производится, называется методом МО-КВ.
С формальной точки зрения, учет КВ производится следующим образом: если у молекулы имеется несколько возможных состояний, описываемых волновыми функциями, у которых спиновой множитель один и тот же, а пространственные множители имеют один и тот же тип пространственной симметрии, то из этих волновых функций следует составить линейную комбинацию. При соответствующем подборе коэффициентов такой линейной комбинации можно существенно улучшить расчетное значение полной энергии молекулы.
В нашем случае молекулы водорода имеются две подходящие волновые функции: Ф1 = [ GG ](ab – ba) и Ф4 = [ UU ](ab – ba). Спиновые множители полностью совпадают, пространственные множители в обоих выражениях относятся к четному типу. Тогда исправленная (с учетом КВ) волновая функция молекулы будет иметь вид:
Фg = { C 1[ GG ] + C 2[ UU ]}(ab – ba)
где коэффициенты С 1 и С 2 должны быть оптимизированы вариационным методом (расчет дает такие значения: С 1 = 0,866 и С 2 = – 0,500).
С физической точки зрения это означает, что два "чистых" состояния — [ GG ] и [ UU ] — не являются стационарными и могут переходить друг в друга. Истинно стационарным является "суперпозиционное" состояние Фg.
Принципиальное отличие заключается в том, что любому "чистому" состоянию соответствует строго определенная электронная конфигурация (т.е. способ распределения электронов по молекулярным орбиталям). Для суперпозиционного состояния указать конкретную конфигурацию невозможно. При попытке установить положение электронной пары мы будем находить ее либо в конфигурации GG (с вероятностью | C 1|2» 0,75), либо в конфигурации UU (с вероятностью | C 2|2» 0,25). Другими словами, истинное состояние электронов не может быть задано какой-либо одной конфигурацией — всегда необходимо учитывать несколько возможных вариантов. (Отсюда и термин — "конфигурационное взаимодействие".)
Можно проанализировать физический смысл конфигурационного взаимодействия и с другой стороны. Когда мы для представления молекулярных орбиталей пользуются атомным базисом (МО ЛКАО), делается серьезная ошибка. Настоящие базисные состояния определяются измерительным прибором — системой перегородок, разделяющих молекулу на одноядерные фрагменты:

Результатом разделения является переход молекулярного одноэлектронного облака, делокализованного по всему ядерному остову молекулы, в облако, локализованное в окрестности только одного ядра. Именно такие конечные состояния (резонансные формы) и описывают правильные базисные функции y1, y1, … Хотя такая функция описывает электронное облако, локализованное в окрестности одного ядра, это облако не является полностью изолированным. Напротив, оно подвергается кулоновскому воздействию со стороны остальных достаточно близко расположенных ядер молекулы. Поэтому использование в качестве базисных функций атомные орбитали, характерные для изолированных атомов, является довольно грубым приближением. Например, в изолированном атоме водорода состояние электрона точно описывается волновой функцией 1s, чему соответствует сферически симметричное распределение электронной плотности. Если к этому атому приблизить с одной стороны еще одно атомное ядро, то под его влиянием электронное облако деформируется, распределение электронной плотности уже не буде сферически симметричным, а волновая функция уже будет существенно отличаться от идеального типа 1s.
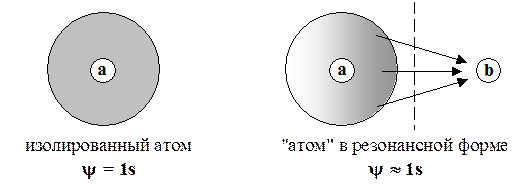
Включение в линейную комбинацию нескольких волновых функций для разных конфигураций приводит к более адекватной картине распределения электронной плотности в молекуле и, соответственно, к более низкой полной энергии.
|
|
Дата добавления: 2015-06-04; Просмотров: 1338; Нарушение авторских прав?; Мы поможем в написании вашей работы!