
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость осадка в отсутствие избытка одноименного иона будет равна
|
|
|
|
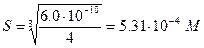
Значит потери за счет растворимости Мg(ОН)2 (М =58,320) в 250 мл составляют 5,31×10-4×0,250×58,320=7,74×10-3 г Mg(OH)2 или 3,87%
При использовании в качестве промывной жидкости раствора аммиака растворимость Mg(OH)2 понижается за счет введения одноименных с осадком ионов OH-. Зная, что потери должны составлять 0,1%, находим растворимость Mg(OH)2:
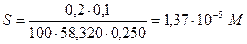
Следовательно, [Мg2+]=1,37×10-5 M. Отсюда, на основании произведения растворимости, имеем
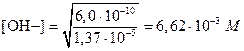
На основании константы диссоциации NН3
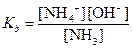
вычисляем концентрацию NН3 в растворе, в котором [ОН-]=6,62×10-8 M. Так как в водном растворе аммиака [NH4+]=[ОН-], то из константы диссоциации следует
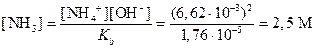
Пример 8. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. Из раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, осаждается половина бария. Какова теоретическая молярная доля PbCO3 в осадке:
а) если ни какого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
Решение.
а) После осаждения половины бария, [Ba2+]=5×10-4 M. Концентрация карбонат-иона, [CO32-]=8×10-9/5×10-4 =4×10-5 M. При этой концентрации карбоната [Pb2+]=7.3×10-14/4×10-5=1.83×10-9 M, т.е. свинец практически полностью переходит в осадок. Отсюда молярная доля PbCO3 в осадке
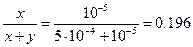
б) 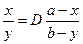 , D=8×10-9/7.3×10-14=1.10×105.
, D=8×10-9/7.3×10-14=1.10×105. 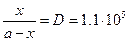 , x» a =10-5,
, x» a =10-5,
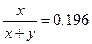
в) l=1.10×105, 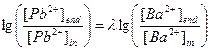 ,
, 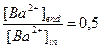 ,
, 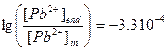 .
.
x» a =10-5, 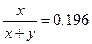
Пример 9. Произведения растворимостей BaCO3 и PbCO3 соответственно равны 8×10-9 и 7.3×10-14. К 1 л раствора, содержащего 0.001 M Ba2+ и 10-5 Pb2+, добавляют 0.0011 М карбоната. Каковы концентрации катионов бария и свинца, оставшихся в растворе,
а) если никакого соосаждения не происходит,
б) если происходит равномерное распределение примеси,
в) если происходит логарифмическое распределение примеси?
Решение.
а) После добавления карбоната в осадок практически полностью выделяется ион бария. Если в первом приближении пренебречь образованием PbCO3, то [CO32-]=0.0011-0.001=10-4 M. Произведение концентраций [Pb2+]in×[CO32-]=10-9 > 7.3×10-14. Другими словами, в осадок будут выделяться оба катиона. В соответствии с этим
[CO32-]=0.0011-0.001-10-5+8×10-9/[CO32-]+7.3×10-14/[CO32-].
Решением этого квадратного уравнения является [CO32-]=1.45×10-4 М.
Отсюда для равновесных концентраций катионов в растворе получаем:
[Ba2+]end=8×10-9/1.45×10-4=5.5×10-5 М, [Pb2+]end=7.3×10-14/1.45×10-4=5.0×10-10 М
б) Из пункта а) следует, что как барий, так и свинец практически полностью выделяются в осадок. Если принять, что образующийся твердый раствор является идеальным, то активность соответствующего компонента в твердой фазе будет равна его молярной доле в ней:
a (PbCO3)=10-5/(0.001+10-5)=9.9×10-3»0.01, a (BaCO3)»1-0.01=0.99.
[Pb2+]end×[CO32-]=ПР(PbCO3)× a (PbCO3), [Pb2+]end=7.3×10-14×0.01/1.45×10-4=5.0×10-12 М
[Ba+]end×[CO32-]=ПР(BaCO3)× a (BaCO3), [Ba2+]end=8×10-9×0.99/1.45×10-4=5.6×10-5 М
в) l=8×10-9/7.3×10-14=1.10×105, 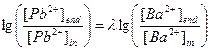 ,
,
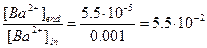 ,
, 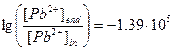 , [Pb2+]end»0.
, [Pb2+]end»0.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1112; Нарушение авторских прав?; Мы поможем в написании вашей работы!