
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрование по методу окисления - восстановления
|
|
|
|
Задачи
1. Сульфат, содержащийся в 1,515 г пробы, осадили методом гомогенного осаждения, добавив 50,0 мл 0,0264 М раствора BaЭДТА, и медленно подкислили для освобождения ионов Ba2+. По окончании осаждения раствор забуферили до рН=10 и разбавили точно до 250 мл. На титрование 25,0 мл прозрачного раствора потребовалось 28,7 мл стандартного 0,0154 М раствора Mg2+. Рассчитайте содержание Na2SO4×10H2O в пробе.
2. Раствор ЭДТА приготовили растворением 8,64 г чистой H4Y (мол, масса 292) в небольшом объеме гидроксида натрия и разбавлением точно до 500 мл. Рассчитайте для этого раствора а) титр по Са2+, мг/мл, б) титр по MgCO3, мг/мл.
3. В 550 мл раствора цианида калия содержится 1,62 г KCN. Найдите для этого раствора а) молярную концентрацию, б) в соответствии с реакцией
Cu2++4CN-ÛCu(CN)4-,
титр по Cu2O, мг/мл.
4. На титрование 50,0 мл раствора, содержащего железо (II) и железо (Ш), потребовалось 13,7 мл 0,0120 М раствора ЭДТА при рН 2,0 и 29,6 мл при рН 6,0. Выразите концентрацию раствора каждого из растворенных веществ в г/мл.
5. Какую навеску смеси с массовой долей NaBr 15 % и NaCl 75 % нужно взять для анализа, чтобы на ее титрование расходовалось 15 мл 0,15 М раствора Hg(NO3)2?
6. Хром (r =7,10 г/см3), выделенный на поверхности площадью 9,75 см2, растворили в соляной кислоте; раствор затем разбавили точно до 100 мл. 25,0 мл раствора забуферили до рН=5 и добавили 50,0 мл 0,00862 М раствора ЭДТА. На титрование избытка ЭДТА потребовалось 7,36 мл 0,01044 М раствора Zn2+. Рассчитайте среднюю толщину хромового покрытия.
7. Какую навеску смеси, содержащей по массе 36 % NaBr и 46 % KBr, следует взять при меркуриметрическом титровании бромидов 0,050 М раствором Hg(NO3)2 из бюретки номинальной вместимости 25 мл?
8. Ионы серебра, содержащиеся в 25,0 мл пробы, превратили в цианидный комплекс, добавив 30,0 мл 0,0800 М раствора Ni(CN)42–. Реакция:
Ni(CN)42–+2Ag+Û2Ag(CN)2–+Ni2+.
На титрование выделившихся ионов никеля израсходовали 43,7 мл 0,0240 М раствора ЭДТА. Рассчитайте концентрацию серебра в растворе.
9. Какую навеску силиката с массовой долей Fe2O3 около 4 % следует взять для прямого комплексонометрического титрования железа (III), чтобы затратить около 20 мл 0,20 М раствора ЭДТА?
10. Ионы калия из пробы минеральной воды объемом 250 мл осадили с помощью тетрафенилбората натрия
K++(С6Р5)4B–®KB(С6Р5)4(тв)
Осадок отфильтровали, промыли и растворили в органическом растворителе. Добавили избыток хелата ртути (II) с ЭДТА:
4HgY2–+(C6H5)4B–+4H2O®H3BO3+4(C6H5)Hg++4HY3–+OH–.
На титрование выделившейся ЭДТА израсходовали 29,64 мл 0,0558 М раствора Mg2+. Рассчитайте содержание ионов калия в пробе, мг/л.
11. Титруют 25,0 мл 0,0200 М раствора Ni2+ 0,0100 М раствором Na2H2Y при рН 10,0, поддерживаемым с помощью NH3 и NH4+ (a4=0.355, a0*=1.34×10-4). Рассчитайте pNi после добавления 45,0; 50,0; 55,0 мл титранта.
12. Какую массу минерала, содержащего около 75 % KCl, следует взять для приготовления 200,0 мл раствора, чтобы на титрование 250 мл его расходовалось 20,0 мл 0,1 М раствора Hg(NO3)2?
Пример 1. Рассчитайте концентрации реагентов и продуктов реакции в точке эквивалентности при титровании 0,100 н. раствора Fe2+ 0,100 н. раствором Се4+ при 25 °С, если оба раствора являются 1,0 М по H2SO4.
Решение. В данном случае для вычисления потенциала в точке эквивалентности удобно воспользоваться формальными потенциалами:
E°=(1,44+0.68)/2=1,06 B.
Молярное отношение Fe2+ и Fe3+ в точке эквивалентности можно найти по уравнению Нернста:
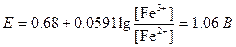

Ясно, что в точке эквивалентности большая часть Fe2+ превращена в Fe3+. С учетом разбавления можно сказать, что концентрация Fe3+ практически равна половине исходной концентрации Fe2+:
[Fe3+]=0,050 М.
Таким образом,
[Fe2+]=4×10-70,050=2×10-8 М.
Аналогичные результаты были бы получены, если уравнение Нернста применить для системы церий(IV) - церий(III).
Пример 2. Выведите уравнение для расчета потенциала в точке эквивалентности несколько более сложной реакции:
5Fe2++MnO4-+8H+Û5Fe3++Mn2++4Н2О.
Решение. Соответствующие полуреакции можно представить в виде
Fe3++e-ÛFe2+,
MnO7-+8H++5е-ÛМп2++4Н2О.
Потенциал этой системы можно вычислить по уравнению
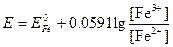
или
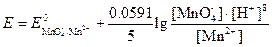
Для того чтобы при объединении выражений, стоящих под знаком логарифма, концентрации различных частиц сократились, уравнение полуреакции для перманганата необходимо умножить на 5 и сложить:
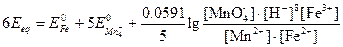
Стехиометрия реакции в точке эквивалентности требует, чтобы
[Fe2+]=5[Mn2+]
[Fe3+]=5[MnO4-]
Подстановка найденных соотношений и преобразование дают

Обратите внимание на то, что для данного титрования потенциал в точке эквивалентности зависит от рН.
Пример 3. Выведите уравнение для расчета потенциала в точке эквивалентности реакции
6Fe2++Cr2O72-+14Н+Û6Fe3++2Cr3++7H2O.
Решение. Поступая, как и в предыдущем примере, мы приходим к выражению

В точке эквивалентности
[Fe2+]=3[Cr3+]
[Fe3+]=6[Cr2O72-]
Подстановка этих соотношений в предыдущее выражение дает
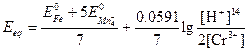
Пример 4. Постройте кривую титрования 50,00 мл 0,0500 н. раствора железа (II) 0,1000 н. раствором церия (IV), полагая, что оба раствора являются 1,0 М по H2SO4.
Решение. В данном случае мы будем пользоваться формальными, а не стандартными потенциалами.
Исходное значение потенциала. Раствор не содержит ионов церия. Вследствие окисления железа(П) кислородом воздуха в растворе содержится небольшое неизвестное количество железа (III), поэтому, не зная этой величины, мы не можем рассчитать исходное значение потенциала.
После добавления 5,00 мл церия(IV). После добавления данного объема окислителя в растворе появляются в ощутимых количествах три участника реакции; концентрация четвертого - церия (IV) -очень низка.
Равновесная концентрация церия(III) равна общей его концентрации за вычетом концентрации непрореагировавшего церия (IV):

Такое приближение вполне допустимо, поскольку константа равновесия реакции имеет большую величину. Аналогично
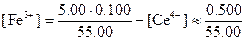

Как мы уже видели, потенциал системы можно рассчитать с помощью любого из двух уравнений:
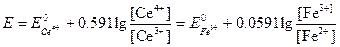
Второе уравнение в данном случае более удобно, поскольку входящие в него концентрации с приемлемым приближением известны. Подставляя в это уравнение равновесные концентрации железа (II) и железа(III), получаем
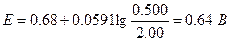
При использовании формального потенциала системы церий(IV) - церий(Ш) и равновесных концентраций этих ионов мы получили бы то же значение потенциала.
Таким же образом можно получить значения потенциалов, необходимые для построения кривой вплоть до точки эквивалентности.
Потенциал в точке эквивалентности. Мы уже видели, что для данного титрования потенциал в точке эквивалентности равен 1,06 В.
После добавления 25,10 мл реагента. Теперь раствор кроме эквивалентных количеств железа (III) и церия(III) содержит избыток церия(IV). Концентрация железа(II) будет очень мала, поэтому
 ,
,
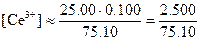 ,
,

С точки зрения величины константы равновесия эти приближения вполне допустимы. Как и прежде, значение потенциала можно рассчитать по уравнению для системы железо (III) - железо (II). Однако на этой стадии удобнее использовать потенциал системы церий(IV) - церий(III), поскольку известны равновесные концентрации этих ионов. Поэтому

Аналогично можно рассчитать значения потенциалов после точки эквивалентности.
Пример 5. Постройте кривую титрования 50,00 мл 0,0500 н. раствора железа (П) 0,1000 н. раствором КМпО4. Для удобства предположим, что оба раствора являются 1,0 М по H2SO4.
Решение. Поскольку формальный потенциал системы Mn(VII) - Mn(II) неизвестен, будем использовать стандартный потенциал, равный 1,51 В.
При титровании протекает реакция
5Fe2++MnO4-+8H+Û5Fe3++Mn2++4H2O.
Следует заметить, что в уравнение Нернста входят молярные концентрации, а не нормальности растворов. В рассматриваемой реакции для частиц, содержащих марганец, молярность равна одной пятой нормальности раствора.
Потенциалы до точки эквивалентности. До точки эквивалентности потенциалы легко рассчитать, зная равновесные концентрации железа (II) и железа (III) в растворе.
Потенциал в точке эквивалентности. В точке эквивалентности потенциал для данной реакции рассчитывают по уравнению

В 1 М H2SO4 [H+]=1,0 M, следовательно, Eeq=1.37 B.
Потенциалы за точкой эквивалентности. Если добавлено 25,10 мл 0,1000 н. раствора KMnO4, то равновесные концентрации с учетом стехиометрии реакции равны:


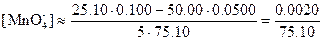
Теперь целесообразно рассчитать электродный потенциал по стандартному потенциалу системы марганец (VII)—марганец (II):
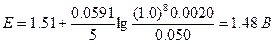
Пример 6. На титрование 2,025 г Nа2С2О4 идет 24,10 мл раствора КMnО4. Рассчитать: а) титр раствора КМпО4; б) титр КMnО4 по Nа2С2О4.
Решение. Вычисления целесообразно вести в следующей последовательности:

Согласно уравнению реакции
5C2O42-+2MnO4-+16H+®10CO2+2Mn2++8H2O
в конечной точке nC2O4-/nKMnO4=5/2 или nKMnO4=2/5nC2O4-
Отсюда

Пример 7. Навеску 1,80 г сплава, содержащего 1,5% хрома растворили в Н2SО4 и окислили ионы Сг3+ до Сr2О72-. К раствору добавили 25,00 мл раствора FeSО4; на титрование избытка последнего израсходовали 5,00 мл раствора КМnО4. Предварительно определили, что на титрование 25,00 мл раствора FeSО4 расходуется 24,80 мл раствора КМnО4. Рассчитать: а) T(KMnO4/Cr); б) T(FeSO4).
Решение. Для определения условного титра обходимо вычислить массу хрома,
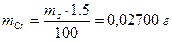
а также объем раствора КМnО4, соответствующий содержанию хрома в образце:
VКМnО4=24,80-5,00=19,80 мл,
следовательно,

Из условия задачи следует, что объем раствора железа, соответствующий содержанию хрома в образце, будет равен

Согласно уравнению реакции
6Fe2++Cr2O72-+14H+®6Fe3++2Cr3++7H2O,
nFeSO4/nCr=nFe/nCr=3.
Отсюда масса железа в 19,96 мл его раствора будет равна
 и
и

Пример 8. Рассчитать индикаторную ошибку титрования 20мл 0,1 н. VОSO4 0,1 н. раствором КMnО4 при рН=0 с N-фенилантраниловой кислотой в качестве индикатора (ннтервал перехода равен E°инд±0,03 В)
Решение. При расчете необходимо использовать следующие полуреакции:
VО++2Н++e-ÛVO2++Н2О, Е1°=0,9994В, z1=1
MnO4-+8Н++5e-ÛMn2++4Н2О, E2°=-1,51 В, z2=5
Отсюда в точке эквивалентности

Eинд°=1,08 В, поэтому интервал перехода будет равен 1,08±0,03=1,11-1,05 В. Следовательно, при использовании этого индикатора раствор будет недотитрован и потенциал будет контролироваться сопряженной парой VO2+/VO+:
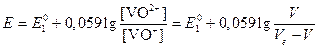 .
.
Отсюда для индикаторной погрешности титрования с N-фенилантраниловой кислотой получим

Для интервала перехода 1,11-1,05 В относительная погрешность титрования будет находиться в пределах (1,32-1,22)×10-2 или 1,32-1,22%.
Следовательно, при титровании с N-фенилантраниловой кислотой раствор VO2+ будет недотитрован. Для точных титрований этот индикатор рекомендовать нельзя.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 2676; Нарушение авторских прав?; Мы поможем в написании вашей работы!