
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрование по методу осаждения и по методу комплексообразования
|
|
|
|
Задачи
1. Вычислите концентрацию раствора H2SO4 в моль/л, титр которого равен 0,02446 г/мл.
2. В воде растворили 28,00 г х.ч. KOH и 40,20. г х.ч. NaOH и разбавили раствор до 1500 мл. Рассчитайте концентрацию полученного раствора как титранта для титрования кислот.
3. Вычислите концентрацию раствора NaOH в моль/л, титр которого равен 0,004020 мг/мл.
4. К 550 мл 0,1925 М HCl прибавили 50,00 мл раствора HCl с титром 0,02370 г/мл. Вычислите концентрацию и титр полученного раствора.
5. Вычислите концентрацию раствора HCl в моль/л, если Т (HCl/KOH)= 0,01353 г/мл.
6. Сколько мл воды надо добавить к 1 л 0,5300 М HCl, чтобы получить 0,5000 М раствор?
7. Вычислите концентрацию раствора NaOH в моль/л, если Т (NaOH/CaO) = 0,002914 г/мл.
8. Сколько мл HCl (d=1,19 г/см3) необходимо для приготовления 1,0 л 0,1 М раствора?
9. Концентрация раствора H2SO4 равна 0.0504 М. Рассчитайте Т(H2SO4).
10. Концентрация раствора NaOH равна 0.09981 М. Рассчитайте Т(NaOH/H3PO4).
11. Концентрация раствора NaOH равна 0.01097 М. Рассчитайте Т(NaOH/SO3).
12. Концентрация раствора KOH равна 0.01097 М. Рассчитайте Т(KOH/SO2).
13. Вычислите концентрацию раствора HClO4 в моль/л, титр которого равен 0,01445 г/мл.
14. В воде растворили 28,00 г х.ч. KOH и 40,20 г NaOH и разбавили раствор до 1500 мл. Рассчитайте концентрацию полученного раствора как титранта для титрования кислот.
15. Вычислите концентрацию раствора NaOH в моль/л, если Т(NaOH/SO3) = 0,02174 г/мл.
16. Сколько мл серной кислоты (d=1.835 г/см3) требуется для приготовления 2,5 л 0,1 М раствора?
17. Сколько г щелочи, содержащей 98% NaOH и 2% индифферентной примесей, необходимо для приготовления 200 мл 0,1 М раствора?
18. Сколько мл серной кислоты (d=1.835 г/см3) требуется для приготовления 2,5 л 0,1 М раствора?
19. Сколько граммов щелочи, содержащей 98% NaOH и 2% индифферентных примесей, необходимо для приготовления 200 л 0,1 М раствора?
20. Определить Т(KOH/P2O5) раствора едкого кали, используемого при определении Р2O5 в суперфосфате (Н3РО4 титруется до KH2PO4), если на титрование 18,00 мл 0,09064 М HCl израсходовано 19,32 мл KOH.
21. До какого объема нужно довести раствор, в котором содержится 1,530 г NaOH, чтобы на титрование 20,00 л раствора израсходовать 14,70 мл HCl (T(HCl)=0,003800)?
22. Вычислить число граммов N2O5 на 1 мл раствора HNO3, если на титрование 20,00 мл раствора кислоты израсходовано 21,12 мл 0,1120 М NaOH.
23. На титрование раствора, полученного из 0,1370 г щавелевой кислоты, израсходовано 22,10 мл 0,09840 М NaOH. Сколько молекул кристаллизационной воды содержала кислота?
24. Навеску 2,0712 г технической буры растворили в мерной колбе емкостью 100 мл. На титрование 20,00 мл раствора израсходовали 21,80 мл HCl (T(HCl/NaOH) =0,003974). Вычислить процентное содержание х.ч. Na2B4O7×10H2O.
25. Навеску 1,000 г суперфосфата обработали водой. На титрование фильтрата до перехода Н3РO4 в NaH2PO4 израсходовали 17,60 мл раствора NaOH (T(NaOH/P2O5) = 0,007251). Вычислить процентное содержание P2O5 в суперфосфате.
26. Для анализа взяли 50,00 мл раствора соляной кислоты и разбавили водой до 1000 мл. На титрование 20,00 мл раствора NaOH (Т(NaOH/h2so4) = 0,004189) израсходовали 18,20 мл полученного раствора кислоты. Вычислить концентрацию HCl в исходном растворе (г/л).
27. На нейтрализацию 0,4000 г смеси, состоящей из х.ч. карбонатов натрия и калия, израсходовали 22,00 мл 0,3000 М раствора кислоты. Вычислить процентное содержание Na2CO3 и K2CO3 в смеси.
28. Какую навеску х.ч. NaNO3 взяли для анализа по методу восстановления NO3- до NH3, если выделившийся аммиак был поглощен 40,00 мл 0,1245 М HCl и избыток кислоты оттитрован 22,40 мл 0,1002 М NaOH?
29. Навеску (NH4)2SO4 растворили в мерной колбе емкостью 100 мл. К 20,00 мл раствора прибавили 50,00 мл 0,1122 М NaOH и нагрели до полного удаления NH3. Остаток щелочи оттитровали 18,00 мл раствора HCl (20,00 мл раствора NaOH эквивалентны 21,00 мл раствора HCl). Сколько граммов (NH4)2SO4 содержалось в растворе?
30. Навеску 0,1032 г Na2CO3 обработали 50,00 мл 0,09496 М HCl, избыток кислоты оттитровали 24,80 мл 0,1298 М NaOH. Вычислить процентное содержание индифферентных примесей в образце.
31. К 0,4789 г. смеси х.ч. SrCO3 и х.ч. Li2CO3 добавили 40,00 мл 0,5100 М HCl. Избыток кислоты оттитровали 20,00 мл NaOH (T(NaOH/ HCl) = 0,01825). Вычислить процентное содержание SrCO3 и Li2CO3.
32. Какую навеску нашатыря, содержащего около 30% NH3, взяли для анализа, если после добавления к ней 50,00 мл 0,1000 М NaOH и нагревания до полного удаления аммиака, избыток NaOH оттитровали 25,00 мл 0,1000 М HCl?
33. Навеску 2,0000 г неизвестного вещества растворили в мерной колбе емкостью 100 мл. На титрование 25,00 мл раствора израсходовали 20,00 мл 0,4455 М HCl. Определить, что входило в состав анализируемого вещества: КОН или NaOH.
34. Какую навеску х.ч. безводной соды нужно взять, чтобы на ее титрование до СО3 израсходовать 20 мл 0,1 М HCl?
35. Молярную концентрацию раствора H2SO4 была установлена по карбонату кальция, содержащему 91,90% СаСO3 без примеси других оснований. К навеске 0,6724 г добавили 29,87 мл кислоты и избыток ее оттитровали 10,27 мл раствора NaOH (1 мл H2SO4 эквивалентен 1,024 мл NaOH). Вычислить молярную концентрацию H2SO4 и NaOH.
Пример 1. Экспериментально найдено, что в среднем наблюдатель может обнаружить красную окраску Fe(SCN)2+ при концентрации 6,4×10-6 М. Какую концентрацию Fe3+ следует создать при титровании 50,0 мл 0,050 М раствора Ag+ 0,100 М раствором KSCN, чтобы свести ошибку титрования к нулю?
Решение. Чтобы ошибка титрования была равна нулю, окраска FeSCN2+ должна появиться при концентрации Ag+, остающегося в растворе, равной суммарной концентрации роданида:
[Ag+]=[SCN-]+[Fe(SCN)2+]=[SCN-]+6,4×10-6
или
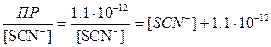
Преобразуем
[SCN-]2+6,4×10-6×[SCN-]-1,1×10-12 =0, [SCN-]=1,7×10-7 M
Константа устойчивости FeSCN2+ равна

Подставим теперь в выражение для константы устойчивости концентрацию [SCN-], обеспечивающую образование заметного для глаза количества FeSCN2+ в точке эквивалентности:

[Fe3+]=27 M.
Пример 2. Какую навеску вещества, содержащего 60% NaCl и 37% КСl (остальное - индифферентные примеси), следует взять для анализа, чтобы расход 0,1 М АgNO3 на титрование не превышал 20,00 мл?
Решение, Если для анализа взято х г вещества, то число молей NаСl и КСl, содержащееся в навеске, равно
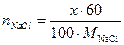

Кроме того,
nNaCl+nKCl=nAgNO3,
где nAgNO3=с AgNO3V AgNO3 - число молей AgNO3, затраченное на титрование.
Сочетание этих соотношений дает уравнение, решением которого является х =0,1313 г.
Пример 3. В мерной колбе емкостью 500 мл растворили г КСl. К 25,00 мл раствора прибавили 50,00 мл 0,08470 M АgNО3. На титрование избытка Аg+ расходуется 23,88 мл раствора роданида аммония (ТNH4SCN/Ag=0,01068). Вычислить процентное содержание КСl образце.
Решение. Число молей АgNО3 (n1), введенное с раствором АgNО3 будет равно n1=cAgNO3×VAgNO3
Число молей (n2) NH4SCN, израсходованное на титрование избытка иона Аg+, еоставит
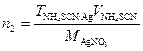
Тогда число молей (n3) КСl определится как разность: n3=n2-n1
Процентное содержание КСl в образце вычислим по формуле
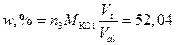
Пример 4. Постройте кривую титрования 50,0 мл 0,0100 М Са2+ 0,0100 М раствором ЭДТА в буферном растворе с рН 10,0.
Решение. Расчет условной константы. Величину условной константы устойчивости комплекса кальция с ЭДТА при рН 10 можно получить из константы устойчивости комплекса и величины и a4 для ЭДТА при рН 10:
K¢CaY=a4 KCaY=0.35×5×1010=1.75×1010
Вычисление рСа до точки эквивалентности. До достижения точки эквивалентности общая концентрация Са2+ равна сумме концентраций неоттитрованного избытка ионов Са2+ и ионов Са2+, образующихся за счет диссоциации комплекса; концентрация комплекса будет равна общей концентрации ЭДТА, т.е,
 .
.
Обычно вполне логично предположить, что величина второго члена в приведенном выше уравнении мала по сравнению с концентрацией незакомплексованного иона Са2+. Поэтому, например, после добавления 25,0 мл титранта

и
pCa=2.48
Значение рСа в точке эквивалентности. В этот момент концентрация CaY2- в растворе равна 0,00500 М, и диссоциация этого комплекса служит единственяым источником ионов Са2+. Очевидно, что концентрация ионов Са2+ будет также равна общей концентрации незакомплексованной ЭДТА, т.е.
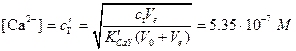 , рСа=6,27.
, рСа=6,27.
Вычисление рСа за точкой эквивалентности. За точкой эквивалентности общие концентрации CaY2- и ЭДТА вычислить легко. Например, после добавления 60,0 мл титранта
 ,
,
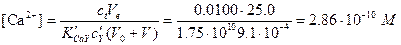 ,
,
рСа = 9,54.
Пример 5. Рассчитайте pZn в растворах, полученных при смешивании 40,0; 50,0 и 60,0 мл 0,00100 М раствора ЭДТА с 50,0 мл 0,00100 М раствора Zn2+. Полагаем, что и раствор Zn2+, и раствор ЭДТА содержат 0,100 М NH3 и 0,176 М NH4C1, и при этом создается постоянное значение рН, равное 9,0. Константы устойчивости аммиачных комплексов Zn2+ следующие: b1=1,9×102, b2=4,4×104, b3=1,04×107 и b4=l.14×109.
Решение. Расчет условной константы. Чтобы найти a, примем [NН3]=cNн3 и подставим в уравнение для a значения cNH3 и ступенчатых констант устойчивости bi
a=1/(1+19+420+1,04×104+1,14×105)=8.0×10-6
Подставляя a в уравнение для K¢ZnY значения KZnY и a4 при рН 9,0, находим
K¢ZnY= 5,2×10-2×8,0×10-6×3,2×1016=1,33×1010.
Расчет pZn после добавления 40,0 мл ЭДТА. Концентрация непрореагировавшего Zn2+ в этот момент с хорошим приближением равна
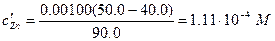
Вычислим равновесную концентрацию иона цинка:
[Zn2+]=a×с¢Zn=8×10-61,11×10-4=8,9×10-10 M, pZn=9.05.
Расчет pZn после добавления 50,0 мл ЭДТА. В точке эквивалентности концентрация cумма равновесных концентраций различных комплексов цинка, не содержащих ЭДТА, равна сумме равновесных концентраций незакомплексованных форм ЭДТА:

[Zn2+]=a×с¢Zn=8×10-61,94×10-7=1,55×10-12 M, pZn=11.81.
Расчет pZn после добавления 60,0 мл ЭДТА. В этом случае в растворе содержится избыток ЭДТА:
 ,
,
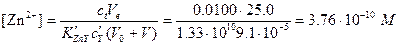 ,
,
pZn=14,52.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 4418; Нарушение авторских прав?; Мы поможем в написании вашей работы!