
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основное титрование
|
|
|
|
Задачи
1. Какую навеску пирита, содержащего около 30% серы нужно взять для анализа, чтобы получить 0,3 г осадка BaSO4?
2. Вычислить фактор пересчета, если при определении мышьяка сначала осадили As2S3, затем окислили серу до SO42-, осадили сульфат хлоридом бария и взвесили BaSO4?
3. Какую навеску Fe3O4 следует взять для получения 1,0 г Fe2O3?
4. Определение содержания серы выполняют по схеме S®H2S®CdS®CuS®CuO. Вычислить фактор пересчета для определения S по CuO.
5. Вычислить фактор пересчета для определения HF, если анализ выполняли по схеме: HF®CaF2®CaSO4.
6. Для определения сульфата в растворе Fe2(SO4)3 осадили Fe(OH)3 и после прокаливания осадка получили гравиметрическую форму Fe2O3. Вычислить фактор пересчета.
7. Вычислить фактор пересчета для определения P2O5, если анализ выполняли по схеме: P2O5®PO43–®(NH4)3PO4×12MoO3®PbMoO4.
8. Вычислить фактор пересчета для определения калия, если после осаждения его в виде K2PtCl6 получена гравиметрическая форма платины.
9. Вычислить фактор пересчета для определения тиосульфата натрия, если после окисления и осаждения получена гравиметрическая форма BaSO4.
10. Вычислить фактор пересчета для определения CaO, если анализ выполняли по схеме: CaO®Ca3(PO4)2®Mg2P2O7.
11. Вычислить фактор пересчета для определения NH3 по хлорплатинатному методу, при котором гравиметрической формой является металлическая платина (NH3®(NH4)2PtCl6®Pt).
12. Сколько вещества, содержащего около 50% железа, следует взять для анализа, чтобы масса прокаленного осадка Fe2O3 была 0,1 г?
13. Анализ карбида кальция выполняли по схеме CaC2®H2C2®Ag2C2®AgCl. Вычислить фактор пересчета для определения CaC2.
14. Смесь бромида и иодида серебра содержит по массе 55,25 % серебра. Вычислить процентное содержание каждой соли в смеси.
15. Рассчитать навеску вещества, содержащего около 1% K2SO4 и 3% KCl, необходимую для получения 0,2 г осадка KClO4.
16. При анализе 0,6528 г вещества получили 0,2825 г смеси сульфатов калия и магния. Масса Mg2P2O7, выделенного из этой смеси, составила 0,1536 г. Вычислить процентное содержание оксидов калия и магния в анализируемом веществе.
17. Из навески 1,0000 г силикатной породы получили смесь солей NaCl и KCl общей массой 0,1015 г. Из этой смеси получили осадок K2PtCl6 0,2040 г. Вычислить процентное содержание Na2O и K2O в силикате.
18. Сульфат алюминия содержит около 88% Al2(SO4)3×18H2O. Рассчитать навеску, необходимую для определения алюминия в виде Al2O3, если масса Al2O3 0,1 г.
19. Какой объем 0,1 М AgNO3 потребуется для осаждения хлора из 1,0 г смеси, содержащей одинаковые массы BaCl2×2H2O и NaCl, если осадитель добавляется в стехиометрическом соотношении?
20. Вычислить потери Са (г и %) за счет растворимости осадка СаС2O4, если к 20 мл раствора, содержащего 0.1 г кальция, прибавили 35 мл 0,25 М (NH4)2C2O4.
21. Сколько процентов составят потери за счет растворимости AgCl при осаждении 0,15 г хлорида эквивалентным количеством нитрата серебра в 1 л раствора?
22. Сколько миллилитров 0,1 н. (NH4)2SO4 нужно прибавить к 300 мл воды, чтобы при промывании осадка 0,5 г BaSO4 этим раствором потери за счет растворимости не превышали 0,01%?
23. Сколько миллилитров 25%-ного NH3 нужно добавить к 150 мл промывной жидкости, чтобы при промывании осадка MgNH4PO4 потери за счет растворимости составили не более 0,0001 г MgO?
24. Вычислить потери PbSO4 (г и %) за счет растворимости осадка, полученного при добавлении к 20 мл 0,1 М Pb(NO3)2 и полуторного избытка 0,1 М H2SO4
25. Сколько миллилитров 0,1 М (NH4)2CO4 необходимо для осаждения кальция и стронция из 200 мл раствора, содержащего в 1 л 0,555 г СаСl2 и 0,317 г SrCl2, если осадитель добавляют в стехиометрическом количестве?
Пример 1. Какую навеску негашеной извести, содержащей 90% СаО и 10% индифферентных примесей, требуется взять для анализа, чтобы на ее нейтрализацию израсходовать 20,00 мл раствора HCl с титром по СаО 0,009000 г/мл?
Решение. Масса СаО соответствующая указанному объему титранта будет равна m (CaO)= T (HCl/CaO)× V (HCl)=0.009000×20=0.18 г. Отсюда для массы навески имеем 0.18/0.9=0.2 г.
Пример 2. Навеска хлорида аммония обработали избытком щелочи. Выделившийся аммиак поглощен 50,00 мл 0,5120 М HCl и полученный раствор разбавлен до 250,0 мл. На титрование 50.00 полученного раствора израсходовано 25,73 мл 0,04870 M KOH. Какова масса NH3, содержащегося в хлориде аммония.
Решение. Число молей НСl, введенное с исходным раствором кислоты, составит n1=cHCl×VHCl=0,05000×0,5120=0.02560. С учетом разбавления этого раствора до 250 мл (Vt) найдем число молей НСl, взятое для анализа (п2)
n 2= n 1× Val / Vt =0.02560×50,00/250=,0.005120
где Val - объем разбавленного раствора НСl, взятый для анализа.
Число молей КОН (п3), израсходованное на титрование избытка кислоты, определим из формулы n 3= c KOH V KOH=0,04870×25,73=
Очевидно, число молей аммиака, содержащегося в аликвотной части раствора п4=п2-n3. Отсюда m NH3= n 4× Vt × M (NH3)/ Val =0,3293 г
Пример 3. Постройте кривую титрования 25,00 мл 0,1000 М раствора малеиновой кислоты 0,1000 М раствором гидроксида натрия.
Решение. Значение рН раствора малеиновой кислоты до начала титрований, было вычислено ранее (см. пример выше); рН=1,54.
Вычисление рН до первой точки эквивалентности. После прибавления раствора щелочи неоттитрованная малеиновая кислота H2M и сопряженное основание НМ- образуют буферный раствор. Учитывая, что по первой ступени диссоциации малеиновая кислота является кислотой средней силы, расчет следует вести по уравнению:
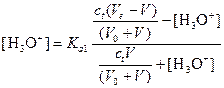 .
.
После преобразования этого выражения имеем:
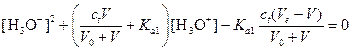 .
.
Например, после добавления 5 мл раствора NaOH и подстановки в приведенное выше выражение получаем квадратное уравнение
[H3O+]2+2.87×10-2[H3O+]-8.00×10-4=0,
решением которого будет [Н3О+]=1,74×10-2 М, рН=1,7б.
Аналогичным образом вычисляют рН во всех точках первой буферной области.
Первая точка эквивалентности. В первой точке эквивалентности имеем раствор амфолита HM- и расчет следует вести с помощью выражения
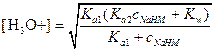
Ясно, что числитель в этом уравнении можно упростить. С другой стороны, концентрация НМ- сравнима с величиной Ka1 поэтому
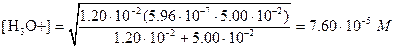
рН=4,12.
Вторая буферная область. Дальнейшее прибавление щелочи приводит к образованию нового буферного раствора, состоящего из неоттитрованной кислоты НМ- и сопряженного с ней основания М2-. Если основание добавлено в количестве, достаточном для того, чтобы пренебречь реакцией взаимодействия НМ- с водой с образованием ОН- (несколько десятых долей миллилитра), рН смеси легко вычислить из Кa2. Для примера вычислим рН после прибавления 25,50 мл раствора NaOH:
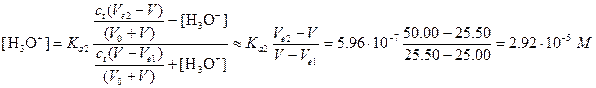 Предположение, что [Н3О+] и [ОН-] малы в сравнении с обеими общими концентрациями, оказалось справедливым, поэтому рН=4,54.
Предположение, что [Н3О+] и [ОН-] малы в сравнении с обеими общими концентрациями, оказалось справедливым, поэтому рН=4,54.
Вторая точка эквивалентности. После прибавления 50,00 мл 0,1000 М раствора NaOH к 25,00 мл 0,1000 М раствора Н2М получим 0,0333 М раствор Na2M. Доминирующим равновесием в этой системе является реакция взаимодействия М2- с водой, и только оно должно быть принято во внимание. Таким образом,
М2-+Н2ОÛОН-+НМ-,
Поскольку Kb1=Kw/Ka2=1.68×10-8 относительно мала, значение во второй точке эквивалентности можно найти по упрощенной формуле
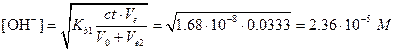 ,
,
рН=14,00-lg(2,36×10-8)=9,37.
Вычисление рН за второй точкой эквивалентности. При дальнейшем прибавлении щелочи диссоциация М2- будет подавлена, поэтому рН раствора рассчитывают по избытку прибавленного титранта.
Пример 4. Раствор содержит одно или несколько из следующих веществ: Na2CO3, NаHCO3, NaOH. На титрование 50,0 мл раствора в присутствии фенолфталеина затратили 22,1 мл 0,100 н. НСl. Вторую порцию раствора объемом 50,0 мл оттитровали в присутствии бромкрезолового зеленого, причем вблизи второй точки эквивалентности раствор прокипятили для удаления CO2. На титрование пошло точно 48,4 мл НСl. Каков состав исходного раствора?
Решение. Если бы раствор содержал только NaOH, на его титрование с любым индикатором были бы затрачены одинаковые объемы кислоты (т.е. Vфф = Vбк). В действительности, однако, на второе титрование пошло 48,4 мл. Поскольку на первое титрование израсходовано меньше половины этого объема, раствор кроме Na2CO3 должен содержать некоторое количество NaHCO3. Теперь мы можем рассчитать концентрации обоих компонентов. В момент достижения рН перехода окраски фенолфталеина первоначально присутствовавший в растворе СО32- превращается в НСО3-. Поэтому
n (Na2CO3)=22,1×0.100/1000=2,21×10-3.
На титрование от точки перехода окраски фенолфталеина до точки перехода окраски бромкрезолового зеленого пошло 48,4—22,1=26,3 мл НС1. Этим количеством кислоты оттитровывается как первоначально присутствовавший бикарбонат, так и бикарбонат, образовавшийся из карбоната. Следовательно,
n (NaHCO3)- n (Na2CO3)=26,3×0,100/1000.
Отсюда
n (NaHCO3) =(2,63-2,21)×10-3=4.2×10-4.
Из этих данных легко рассчитать молярные концентрации:
c Na2CO3=2.21/50=0.0442 ммоль/мл,
c NaHCO3=0,42/50=0.0084 ммоль/мл.
Пример 5. Для определения постоянной жесткости воды к 100 мл воды прибавили 30,00 мл раствора Nа2СО3 (T(Na2CO3/CaO)=0,001025), полученную смесь выпарили досуха и сухой остаток растворили в дистиллированной воде. На титрование фильтрата израсходовано 25,00 мл НСl (Т НС1/СаО=0,000812). Сколько миллиграммов СаО в 1 л воды?
Решение. Масса СаО (в мг), содержащаяся в 100 мл воды, взятой для анализа, находим как разность:
m ¢=(T (Na2CO3/CaO)× V (Na2CO3)- T (HCl/CaO)× V (HCl))×1000
Отсюда содержание СаО (мг) на 1 л воды составит
m = m ¢×1000/100=104,5 мг
Пример 6. Чему равна индикаторная ошибка титрования 0.1 M HCl 0,1 M раствором NaOH с метиловым красным (рТ=5.1)?
Решение. Поскольку титрование закончится при рН 5,1, то сильная кислота в растворе будет недотитрована и
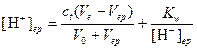
Относительная погрешность титрования будет равна
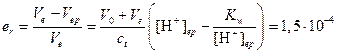
Ошибка мала, поэтому для титрования пригоден индикатор метиловый красный.
Пример 7. Можно ли оттитровать 0,02 M NаОН 0,02 M раствором НСl с: а) фенолфталеином (рТ=9); б) метиловым оранжевым (рТ=4)
Решение. а) Точка эквивалентности достигается в этом случае при рН=7. По окончании титрования (рН=9) в растворе еще имеется неоттитрованная сильная щелочь, поэтому относительную индикаторную погрешность следует рассчитывать по формуле
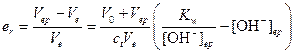
Поскольку V0»Vep»Ve, из приведенного уравнения имеем er»-10-3. Следовательно, индикатор вполне пригоден для титрования.
6) В этом случае титрование заканчивается при наличии в растворе избытка сильной кислоты (рН=4), т. е. раствор будет перетитрован:
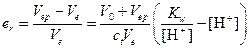
или er»10-2
Большая ошибка не позволяет использовать индикатор метиловый оранжевый в данном титровании.
Пример 8. Вычислить ошибку титрования 0,1 М этаноламина 0,1 М раствором НСl с: а) метиловым красным (рТ=5); б) фенолфталеином (рТ=9).
Решение. В этой задаче применим общий подход для нахождения индикаторной погрешности титрования.
Согласно принципу электронейтральности,
[H+]+[RNH3+]=[Cl-]+[OH-].
Концентрацию иона RNH3+ в любой момент титрования можно рассчитать по уравнению
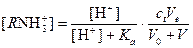 ,
,
где Ka - константа диссоциации RNH3+ (Ka = Kw / Kb, Kb =1,8×10-5).
Концентрация Cl- будет равна
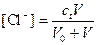
Подставим значения указанных концентраций в уравнение электронейтральности
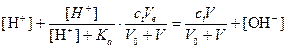
Преобразуя данное уравнение, для относительной индикаторной погрешности имеем
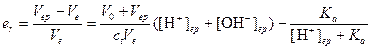 .
.
а) При использовании метилового красного титрование заканчивается при рН 5,0. Отсюда er =1,4×10-4 (0.014%). Так как погрешность положительна раствор несколько перетитрован, однако погрешность мала и индикатор метиловый красный пригоден для титрования
б) При титровании с фенолфталеином титрование заканчивается при рН 9. Относительная погрешность титрования в этом случае будет следующей: er = -3.6×10-1 (36%). Из этого значения погрешности следует, что значительная часть первоначально взятого амина остается неоттитрованной. Следовательно, индикатор фенолфталеин непригоден для данного титрования.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 2943; Нарушение авторских прав?; Мы поможем в написании вашей работы!