
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. Целью данной. Работы является ознакомление с гальваническими элементами, умение измерять ЭДС элемента
|
|
|
|
Целью данной.работы является ознакомление с гальваническими элементами, умение измерять ЭДС элемента, применение метода ЭДС для решения некоторых физико-химических задач (определение рН растворов, констант диссоциации слабых кислот).
Гальванический элемент (или ячейка) представляет собой систему, состоящую из ряда проводящих фаз, находящихся в контакте одна с другой. Обычно это металлические электроды и один или несколько жидких электролитов. На каждой межфазной границе, различающихся по составу, возникает разность
потенциалов.
I.ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Рассмотрим возникновение сказка потенциала на границе электрод-электролит. Возьмем систему, которую в электрохимии принято называть "электрод в растворе своих ионов". Металл состоит из положительно заряженных ионов, расположенных в узлах кристаллической решетки, и относительно свободных электронов. При погружении металлического электрода в раствор электролита между металлом и раствором возникает двойной электрический слой (д.э.с.) и появляется разность потенциалов, вполне, определенная при данных условиях.
Образование д.э.с. связано с рядом причин. Д.э.с., называемый обменным, может образовываться при обмене ионами между электродом и раствором электролита. Если химический потенциал ионов металла в растворе электролита больше, чем ионов в металле, то выделившиеся на поверхности электрода катионы притягивают к себе анионы из раствора. Одной обкладкой д.э.с. служат положительные заряды со стороны металла, другой обкладкой - отрицательные заряды анионов со стороны раствора. Наоборот, если химический потенциал ионов в металле больше химического потенциала его ионов в растворе, то перешедшие из металла в раствор ионы притянутся к его поверхности избыточными электронами. При этом также образуется д.э.с.
Возникновение д.э.с. может быть результатом специфической адсорбции катионов или анионов на
поверхности электрода. Под специфической адсорбцией понимается накопление на поверхности
электрода катионов или анионов под влиянием химических сил.
Если предположить, что поверхность металла не заряжена и существует специфическая адсорбция анионов, то на расстоянии радиуса иона от поверхности появится адсорбционный., слой анионов. Анионы притянут к себе электростатически катионы из раствора и на поверхности металла появится адсорбционный двойной электрический слой.
Если поверхность металла заряжена положительно в результате обмена ионами между металлом и раствором, то под действием электростатических сил адсорбция анионов увеличится» а если поверхность заряжена отрицательно, то уменьшится по сравнению с адсорбцией на незаряженной поверхности. Скачки потенциала в обменном и адсорбционных д.э.с, складываются» если знаки заряда обкладок со стороны металла (и соответственно со стороны раствора) одинаковы, В противном случае суммарный скачок потенциала равен их разности.
Двойной электрический слой может возникнуть также в результате адсорбции поверхностно-активных веществ. При специфической адсорбции полярные молекулы определенным образом ориентируются на поверхности металла и возникает адсорбционный д.э.с. и соответствующий скачок потенциала. В водных растворах электролитов на поверхности металлов всегда имеется двойной электрический слой в результате адсорбции дипольных молекул води. Как правило, разные виды д.э.с. реализуются одновременно.
В зависимости от расположения ненов в двойном электрическом слое различают плотный (слой Гельмгольца) и диффузный (слой Гуи) двойные электрические слои и соответственно два скачка потенциала на границе металл-раствор. Плотный д.э.с. образован ионами из раствора, плотно притянутыми к поверхности металла электростатическими силами и силами специфической адсорбции. Эти ионы расположены в растворе на расстоянии радиуса сольватированного иона от поверхности электрода. Потенциал в плотном д.э.с, изменяется прямолинейно (рис.1).
Диффузный двойной слой образован ионами, которые расположены в растворе на некотором расстоянии от поверхности электрода. Такое расположение ионов получается под влиянием двух противоположных факторов: электростатических сил, которые стремятся притянуть ионы плотно к поверхности электрода, и теплового движения, которое стремится расположить ионы хаотически в растворе, В результате ионы, входящие в, состав диффузного д.э.с. располагаются на некотором расстоянии от поверхности электрода о избыточной плотностью зарядов (до сравнению со средним распределением ионов в растворе), которая постепенно убывает, и на расстоянии в несколько десятков атомных диаметров становится пренебрежимо малой. Потенциал в диффузном д.э.с, изменяется по экспоненте.
Скачок потенциала в диффузном д.э.с. называют диффузным, φ1 -потенциалом. Если общий скачок потенциала обозначить φ, то скачок потенциала в плотном д.э.с. будет φ-φ1.
С увеличением концентрации электролита в растворе двойной электрический слой снимается, и ионы из диффузного д.э.с. переходят в плотный слой. При этом диффузный потенциал уменьшается, а скачок потенциала в плотном д.э.с, увеличивается и при концентрации электролита 0,1-1,0 гэль/л диффузный д.э.с, и диффузный φ1. -потенциал практическиравны нулю.
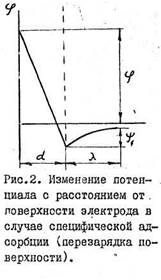
При специфической адсорбции, когда заряд, вносимый адсорбированными ионами, по абсолютной величине больше заряда поверхности, но противоположен по знаку, наблюдается перезарядка поверхности. При перезарядке меняется знак φ1. - потенциала (рис.2),
Скачок потенциала между металлом и раствором называют
электродным потенциалом.
 Строение двойного электрического слоя, распределение. скачка потенциала в приэлектродном слое, величина и знак φ1. -потенциала значительно влияют на особенности электродных реакций.
Строение двойного электрического слоя, распределение. скачка потенциала в приэлектродном слое, величина и знак φ1. -потенциала значительно влияют на особенности электродных реакций.
В электрохимии электродом называют как электрохимическую систему, включающую металл и раствор электролита, так и собственно металл (или полупроводник), С точки зрения электродной реакции электрод - это система металл-раствор электролита, в которой происходит или непосредственный обмен заряженными частицами, или обмен через ряд промежуточных фаз, а гальванический элемент представляет собой систему, состоящую из двух электродов.
Изобразим схематически гальванический элемент
M I| A I ░ A 2 | M 2| M I
где M I и M 2 - металлы; A I и A 2 - электролиты.
Сплошной вертикальной чертой - | обозначают границу раздела между твердыми фазами или между твердой и жидкой фазой,
Штриховой - ░ границу раздела между двумя жидкими фазами.
ЭДС элемента определяется как алгебраическая сумма скачков потенциалов, возникающих на границах раздела фаз.
E = Δ φ M1/A1+Δ φ A1/A2+Δ φ A2/M2+Δ φ M2/M1 (1)
Гальванический элемент, на концах которого один и тот же металл, называется правильно или нормально разомкнутым гальваническим элементом. Разность электрических потенциалов на концах правильно разомкнутого элемента представляет его электродвижущую силу (ЭДС),
Δ φ M2/M1 контактная разность потенциалов;
Δ φ A1/A2 это так называемый, диффузионный потенциал (на границе двух жидких фаз), он обусловливается неодинаковыми скоростями движения ионов и обычно имеет относительно небольшое значение.
В простейших случаях при соприкосновении двух растворов с различной активностью (a1>a2) одного и того же электролита диффузионный потенциал может быть определен из уравнения
φ диф= (λ -- λ+)/(λ -- λ+)∙ RT/F ∙ ℓna1 / a2 (2)
Где:
λ -и λ+ -предельные подвижности аниона и катиона
R- газовая постоянная, равная 8,314 Дж/моль∙К
T- абсолютная температура, К;
F-постоянная Фарадея, равная 96500 Кл/моль.
При равенстве λ - = λ+, φ диф= 0
При точных измерениях ЭДС цепи диффузионный потенциал стремятся настолько уменьшить, чтобы он практически не оказывался на величине ЭДС, Это достигается при установлении между двумя растворами, электролита солевого мостика (электролитического ключа). Он представляет собой U-образную трубку, заполненную раствором (обычно насыпанным) электролита, у которого равны или близки подвижности катиона и аниона (KCI, КNО3, NH4CI, NH4NО3). Схематически принято устранение диффузного потенциала при помощи солевого мостика обозначать двумя вертикальными черточками:
M I| A I|| A 2| M 2 | M I
При записи гальванического элемента контакт между металлами M 2 и M I обычно не показывают, но всегда подразумевают нормально разомкнутый гальванический
Вернемся к уравнению (I),Если диффузионный потенциал устранен (Δ φ A1/A2= 0), а контактную разность потенциалов обычно не записывают то ЭДС нормально разомкнутого гальванического элемента можно записать
E = Δ φ M1/A1+Δ φ A2/M2 (3)
Заменяя Δ φ M1/A1 на - Δ φ A1/M1, Получим
E= Δ φ A2/M2 - Δ φ A1/M1 (4)
Где Δ φ A2/M2 и Δ φ A1/M1 равновесные электродные потенциалы.
Обычно это записывается так: E= φ + -φ -
Где:
φ + потенциал положительного электрода;
φ - потенциал отрицательного электрода
Абсолютные значения потенциалов электродов не определяются, поэтому за условную величину электродного потенциала принимают ЭДС элемента, в котором электродом сравнения служит один и тот же стандартный электрод Ao|Mo тогда условные электродные потенциалы определяются как ЭДС следующих электрохимических цепей:
M I| M o| A o|| A 1| M I
M I | M o| A o|| A 2 | M 2| M I
В качестве стандартного электрода используется нормальный водородный электрод. Определенные таким образом электродные потенциалы носят название стандартных электродных потенциалов.
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью, опущенную в раствор кислоты, в котором активность ионов водорода равна единице.Через раствор периодически пропускается газообразный водород для насыщения водородом платинового электрода. Давление газообразного водорода в стандартном водородном электроде равно Iатм. Условно потенциал водородного электрода принимают за нуль.
Для любого электрода можно измерить потенциал относительно стандартного водородного электрода, составив, например,
цепь
M I | Pt, H2 | H +| A 2 | M 2| M I
PH2 = 1атм,
aH+ = 1
ЭДС такого элемента представляет собой электродный потенциал правого полуэлемента.
Электродный потенциал считается положительным, если при работе в качестве источника тока в паре со стандартным водородным электродом на исследуемом электроде происходит восстановление, и отрицательным, если на нем происходит окисление.
Термодинамика гальванического элемента
Пусть в гальваническом элементе протекает следующая обратимая реакция
υ1 А1 + υ2 А2 Dυ3 А3 + υ4 А4 (5)
Максимально полезная работа гальванического элемента Wmax=zFEравна убыли изобарного потенциала, определяемого выражением
Wmax=zFE= - Δ GP,T (6)
Изотерма химической реакции записывается
Δ GP,T= -RTℓn Ka +RTℓn  (7)
(7)
 Где
Где  произведение активностей всех компонентов реакции., в степенях, соответствующих стехиометрическим коэффициентам этих компонентов. Для рассматриваемого примера.
произведение активностей всех компонентов реакции., в степенях, соответствующих стехиометрическим коэффициентам этих компонентов. Для рассматриваемого примера.
После подстановки уравнения (6) в уравнение (7) и несложных преобразований получаем
E= RT/ZF∙ ℓn Ka-RT/ZF∙ ℓn  (8)
(8)
Если активности всех ионов равны единице, то
RT/ZF∙ ℓn Ka=Eº
где Е°- стандартная ЭДС.
Тогда Уравнение (8) запишется
E=Eº-RT/ZF∙ ℓn  (9)
(9)
Это уравнение Нернста.
Работа гальванического элемента характеризуется изменением изобарного потенциала.
При T=сonst
Δ GT= Δ HT-T Δ S (10)
Где:
Δ HT тепловой эффект реакции при проведении ее внегальванического элемента;
T Δ S теплота, которая выделяется или поглощаетсяпри обратимом протекании реакции в гальваническом элементе;
Δ GTэто то количество теплоты, которое превращается в электрическую работу в гальваническом Известно, что (∂ Δ G/∂T)p= - Δ ST (11)
тогда из уравнений (11) и (6) следует что,
Δ ST=ZF(∂ Δ G/∂T)p (12)
Из уравнений (10) и (11)
Δ GT= Δ H+ T(∂ Δ G/∂T)p (13)
В то же время
- Δ G= Wmax=ZFE,отсюда
- ZFE= Δ H+T(∂ Δ G/∂T)p (14)
Или подставив в это выражение значение Δ Gи решая его относительно Еполучаем
E= - [(Δ HT-TzF(∂ Δ E/∂T)p)/zF] (15)
Это уравнение отражает зависимость ЭДС гальванического элемента от температуры,
(∂ Δ E/∂T)p- температурной коэффициент ЭДС.
Из уравнения (15)
Δ HT= - ZF[E-T(∂ Δ E/∂T)p] (16)
Еcли температурный коэффициент ЭДС элемента положительный то элемент работает с поглощением тепла из окружающей среды при изотермных условиях. И, наоборот если (∂ Δ E/∂T)p<0, то элемент.работает, с выделением тепла в окружающую среду
Рассмотрим на примере гальванического элемента Даниэля-Якоби расчет ЭДС по уравнению Нернста.
־ Zn| ZnSO4|| CuSO4|Cu+
На цинковом электроде идет реакция окисления
Zn = Zn2+ +2e
На медном- реакция восстановления
Cu2++2e= Cu
Суммарная реакция
Zn + Cu2+ = Zn2+ + Cu (17)
Согласно уравнению Нернста ЭДС.равна
E=Eº- (RT/zF)∙ℓn(aZn2+ ∙aCu)/(aZn∙ aCu2+) (18)
Активность чистых веществ равна единице (aCu = 1, aZn =1)
Z=2, а Eº = φºCu2+/Cu-φºZn2+/Zn
Таким образом
E= φºCu2+/Cu - φºZn2+/Zn - RT/2F∙ℓn(aZn2+/aCu2+) (19)
Где:
φºCu2+/Cu и φºZn2+/Zn - стандартные потенциалы медного и цинкового электродов, значения которых берутся из справочников.
Если подставить значения R = 8,314 Дж/моль-К» Т=2Э8 К, аР = 96500 a∙c/моль и перевести натуральный логарифм в десятичный, то уравнение (19) запишется
E= φºCu2+/Cu - φºZn2+/Zn - 0,059/2∙ ℓg(aZn2+/aCu2+) (20)
При записи схем электрохимических систем необходимо соблюдать правила, рекомендуемые конвенцией международного союза по чистой и прикладной химии (1953). Чтобы потенциал полуэлемента (электрода) отвечал знаку электродного потенциала по водородной шкале, полуэлемент должен быть записан таким образом, чтобы вещества, находящиеся в растворе, были помещены слева, а вещество электрода - справа от вертикальной черты
Zn2+/Zn;
H+/H2, Pt;
Co3+/Co2+,Pt;
Cl-/Cl2, Pt
При этом подразумевается, что другим полуэлементом, расположенным слева, служит стандартный водородный электрод. Например, при определении потенциала цинкового электрода необходимо составить следующий гальванический элемент
Pt, H2 |H+ || Zn2+|Zn
Реакции, формально протекающие в такой системе, в соответствии с правилом написания электрохимических цепей можно записать
Zn2+ +2e = Zn на правом полуэлементе
H2 = 2H++2e на левом полуэлементе
Zn2++ H2 = Zn + 2H+ суммарная реакция
При этом электрический ток внутри цеди должен был бы течь слева направо, чтобы ЭДС цепи была положительная.
Практически в элементе электричество внутри цепи течет справа налево/ Поэтому ЭДС рассматриваемого электрохимического элемента так же, как и равный ей потенциал цинка будуnа иметь отрицательный знак.
ТИПЫ ЭЛЕКТРОДОВ
В зависимости от природы электродной реакции различают следующие типы электродов.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 765; Нарушение авторских прав?; Мы поможем в написании вашей работы!