
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С уменьшением давления — в сторону их увеличения
|
|
|
|
Влияние давления и температуры на положение химического равновесия.
Константа равновесия любой химической реакции имеет постоянное числовое значение при неизменных внешних условиях— давлении и температуре.
Если реакция протекает без изменения числа газовых молекул, то изменение объема или давления не происходит и, соответственно, не влияет на смещение константы равновесия.
Если же реакция сопровождается изменением числа газовых молекул, то:
с возрастанием давления положение равновесия смещается в сторону уменьшения числа образующихся газовых молекул, а
На примере реакции диссоциации углекислого газа
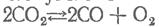
можно заметить, что при заданной температуре увеличение давления приводит к развитию процесса образования молекул углекислогогаза,
в то время как снижение давления вызывает смещениеравновесия в направлении большего выхода окиси углерода.
Аналогично можно доказать, что повышение температуры смещает равновесие в направлении эндотермического процесса (идущего с поглощением тепла).
Чем значительнее тепловой эффект процесса, тем больше меняется константа равновесия и тем сильнее смещается равновесие с изменением температуры. Выводы, вытекающие из анализа зависимости константы равновесия от температуры, имеют большое значение для изучения металлургических процессов при сварке, поскольку такие процессы протекают в условиях высоких температур.
Рассмотренное влияние давления и температуры на положение химического равновесия по сути есть проявлением принципа подвижного равновесия, установленного Ле-Шателье в 1884 г. Этот принцип заключается в следующем:
Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то последнее смещается, причем в системе протекают процессы, ослабляющие эффект внешнего воздействия. Например, повышение температуры, как мы установили, смещает положение равновесия в сторону большего выхода тех веществ, которые образуются с поглощением тепла. Тем самым ослабляется эффект внешнего воздействия — подвода тепла и повышения температуры системы. Понижение температуры системы действует в обратном направлении.
Реакция:
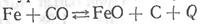
при развитии вправо является экзотермической, а при развитии влево – эндотермической. Поэтому она из состояния равновесия при повышении температуры будет развиваться преимущественно влево, а при понижении температуры – вправо.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 399; Нарушение авторских прав?; Мы поможем в написании вашей работы!