
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса и вычисление теплового эффекта реакций
|
|
|
|
При разработке проектов технологических процессов, сопровождаемых химическими превращениями, важно знать их тепловые эффекты химических реакций.
Эти эффекты определяют с помощью калориметра, но в нем можно осуществить далеко не все реакции. В таких случаях тепловой эффект реакций можно установить, пользуясь законом Г. И. Гесса (1840 г.), согласно которому тепловой эффект реакции не зависит от пути ее (промежуточных стадий), а лишь от начального и конечного состояний. Такое утверждение справедливо при условии, что реакции протекают при постоянном объеме или постоянном давлении. Тогда из уравнений 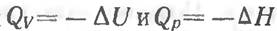
следует, что тепловые эффекты превращений действительно не зависят от пути перехода из одного состояния в другое, так же, как и изменение функций состояния U и Н.
На примере реакции сгорания углерода рассмотрим применение закона Гесса для вычисления теплового эффекта реакции. Сгорание углерода до углекислоты можно провести двумя путями:
1) непосредственным, прямым сгоранием по реакции

2) последовательно, в две стадии, по реакциям

В соответствии с законом Гесса суммарный тепловой эффект двух последних реакций равен тепловому эффекту полного сгорания, так как оба пути имеют одинаковое начальное (С и 02) и конечное (СО2) состояния. Тогда

Пользуясь термохимическими таблицами, с помощью закона Гесса можно вычислить тепловые эффекты любых реакций, если известны энтальпии всех веществ, участвующих в реакциях. Тогда тепловой эффект реакции равен алгебраической сумме энтальпий веществ реакции с учетом коэффициентов химического уравнения.
Обычно в таблицах термодинамических свойств веществ даны стандартные энтальпии (тепловые эффекты при постоянном давлении), отнесенные к 25 °С (298 °К) и внешнему давлению р =1 am. Таким образом,

Для вычисления тепловых эффектов реакций при температурах, отличающихся от стандартных, нужно знать теплоемкости реагирующих веществ и зависимость их от температуры.
Вычисление теплоемкостей веществ. В физической химии обычно пользуются понятием истинной теплоемкости, определяемой как бесконечно малое количество тепла, которое нужно подвести к веществу для повышения его температуры на бесконечно малую величину: 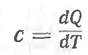
В зависимости от того, к какому количеству вещества относится истинная теплоемкость, она может быть атомной — кал/ (г-атом • °С) или молекулярной — кал/(моль • °С).
Различают теплоемкость при постоянном объеме cv и теплоемкость при постоянном давлении ср. Последняя всегда больше, так как при постоянном давлении теплота расходуется не только на нагревание, но и на совершение работы. Более конкретную зависимость между ср и су можно получить, отнеся в обоих процессах подведенное тепло к одному молю вещества и к 1 °С.

Теплоемкость вещества зависит от температуры, увеличиваясь с повышением последней. Эту зависимость можно выразить с помощью эмпирических уравнений вида степенных рядов:
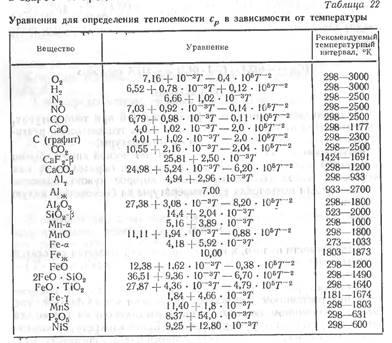
В табл. 22 приведены уравнения для определения теплоемкости ср в зависимости от температуры некоторых веществ, участвующих в сварочных процессах. Т — абсолютная температура, °К.
……………………………………………………………………………..
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 1178; Нарушение авторских прав?; Мы поможем в написании вашей работы!