
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимия
|
|
|
|
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Термохимия – раздел химической термодинамики о тепловых эффектах химических и физико-химических процессов.
Тепловой эффект химической реакции это количество теплоты, которое выделяется или поглощается в процессе реакции (экзо- и эндотермические реакции).
Реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением — эндотермическими.
Тепловой эффект относят, как правило, к одному молю прореагировавшего исходного вещества при стехиометрическом соотношении реагирующих компонентов.
Тепловой эффект, определенный при постоянном давлении, называется изобарным тепловым эффектом, а при постоянном объеме – изохорным тепловым эффектом.
Абсолютное большинство реакций, протекающих в природе, происходит при постоянном давлении, так как окружающая атмосфера практически является бесконечно упругой и давление, оказываемое ею на систему, остается постоянным, независимо от изменения её объема; поэтому в термохимии обычно пользуются изобарными тепловыми эффектами.
На характер протекания химических реакций влияют законы технической термодинамики.
Если химическая реакция идет без изменения объема, то на преодоление сил внешнего давления работа не затрачивается (А = 0) и, следовательно, подвод или отвод тепла из системы реализуется в виде изменения внутренней энергии вещества (нагрев или охлаждение.
Такой процесс наблюдается при взаимодействии твердых или жидких веществ без образования газовой фазы; изменение объема этих веществ настолько мало, что им можно пренебречь. Если химическая реакция протекает при постоянном давлении, часть энергии системы может расходоваться на совершение работы расширения. В этом случае наблюдается изменение объема на ΔV и совершается работа 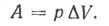 Тогда изменение внутренней энергии DU можно выразить так: DU = QP + A
Тогда изменение внутренней энергии DU можно выразить так: DU = QP + A
При переходе системы из одного состояния в другое в условиях постоянного давления комбинированным показателем состояния вещества является
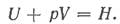
Эта термодинамическая функция называется энтальпией, или теплосодержанием. Она представляет собой сумму внутренней энергии U и работы расширения, или объемной энергии pV, переданной в окружающую среду. Поэтому энтальпию иногда называют энергосодержанием.
Следовательно, уравнение теплового эффекта реакции можно представить так: 
Иначе говоря, поглощенная теплота в процессах, протекающих при постоянном давлении, расходуется на приращение энтальпии.
Таким образом, тепловой эффект реакции при постоянном давлении отличается от теплового эффекта реакции при постоянном объеме на величину совершенной работы: QP = Qv + p*DV
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 908; Нарушение авторских прав?; Мы поможем в написании вашей работы!