
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действующих масс и константа равновесия. Химическое равновесие в гомогенной среде
|
|
|
|
О ХИМИЧЕСКОМ РАВНОВЕСИИ
Химическое равновесие соответствует состоянию покоя в химическом процессе и его достижение подчиняется второму закону термодинамики.
Равновесием называется термодинамическое состояние химической системы, не изменяющееся во времени при данных внешних условиях ее существования и характеризующееся минимальным значением изотермных потенциалов.
Равновесие химических реакций динамическое, подвижное, так как в такой системе одновременно протекают взаимно противоположные процессы: образование из исходных веществ продуктов реакции и из продуктов реакции — исходных веществ.
О совершающихся в химической системе превращениях можно судить по уравнениям реакций. Они дают наглядное представление о ходе химического процесса, позволяют установить количественные соотношения между участвующими в них веществами и выполнять разнообразные расчеты, связанные с количественной стороной процесса.
Однако из химического уравнения неясно, какому соотношению между исходными веществами и продуктами реакции отвечает состояние равновесия и в каком положении относительно равновесия будет находиться данная реакция.
Моль есть количество вещества системы, содержащей столько же структурных элементов (атомов или молекул), сколько содержится атомов в углероде-12 массой 0,012 кг.
При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Количество специфицированных структурных элементов в одном моле вещества называется постоянной Авогадро (число Авогадро равно 6,02214129·1023 моль−1).
|
|
|
Гомогенной называется такая система, внутри которой нет поверхностей раздела, отделяющих одну часть системы от другой. Это может быть, например, газовая смесь, различные жидкие растворы и др.
Рассмотрим химическую реакцию между газообразными веществами: 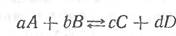
где a, b, c, d — стехиометрические коэффициенты, или число молей, веществ А, В, С, D соответственно. В таком виде химическое уравнение говорит о том, что реакция одновременно идет в обоих направлениях.
Примем, что в направлении слева направо реакция идет с положительным тепловым эффектом. Если в начальный период скорости протекания реакции в прямом и обратном направлениях не одинаковы, то по мере приближения к состоянию равновесия они становятся близкими друг к другу, а при равновесии достигают равных значений.
При заданных внешних условиях наибольшее влияние на скорость протекания реакции оказывает концентрация реагирующих веществ.
Зависимость между этими величинами четко определена законом действующих масс, согласно которому при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждое из них влияет на скорость в степени, равной стехиометрическому коэффициенту в уравнении реакции.
Следовательно, для состояния равновесия реакции должно быть 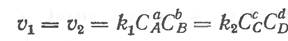
где kx и k2 — константы скоростей реакции; С А, СВ, СС, CD — концентрации веществ,
представленные обязательно в молях на литр. Тогда
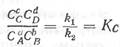
где Кс — константа равновесия реакции.
Таким образом, в состоянии равновесия отношение концентрации веществ, стоящих в правой части уравнения, к концентрации веществ, стоящих в его левой части, есть величина постоянная.
Если вещества, участвующие в реакции, газообразные и подчиняются уравнению идеальных газов (при малых и умеренных давлениях), то константа равновесия реакции может быть выражена иными средствами.
|
|
|
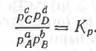
Здесь рс, pD, Ра, Рв - парциальные давления соответствующих газообразных веществ, am.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 535; Нарушение авторских прав?; Мы поможем в написании вашей работы!