
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные элементы физической химии
|
|
|
|
При сварке плавлением между расплавленным металлом, шлаком и окружающей газовой средой протекают сложные физико-химические процессы.
Условия взаимодействия между реагентами в зоне реакции весьма своеобразны и имеют следующие особенности:
1) высокую и быстро изменяющуюся температуру в зоне сварки;
2) кратковременность взаимодействия реагентов;
3) хорошо развитую поверхность взаимодействия.
Чтобы получить металл шва заданного химического состава, нужно уметь управлять ходом металлургических процессов, для чего совершенно необходимо знать основные законы физической химии.
М. В. Ломоносов дал определение физической химии как науки об исследовании химических процессов с помощью физических методов.
В настоящее время физическая химия превратилась в обширную отрасль знаний о наиболее общих законах химических превращений. Одним из важнейших разделов физической химии является химическая термодинамика.
Первое начало? термодинамики.
В термодинамике рассматриваются процессы, связанные с тепловыми явлениями.
Процессы, протекающие в тепловых машинах, изучает техническая термодинамика,
тепловые явления, сопровождающие химические реакции,— химическая термодинамика.
Химическая термодинамика построена, главным образом, на двух началах, или законах, вытекающих из обобщения многовекового человеческого опыта, причем ни одно из следствий этих законов не противоречит опыту.
Начала термодинамики справедливы для любого тела или группы тел. При этом будем иметь в виду, что тело или группа тел, находящихся во взаимодействии и мысленно обособленных от окружающей среды, называются системой.
В основу первого начала термодинамики положен закон сохранения энергии, впервые сформулированный М. В. Ломоносовым (1748 г.). Согласно этому закону взамен энергии одного вида, исчезающей в каком-либо процессе, появляется энергия другого вида в количестве, строго эквивалентном первому.
Техническая термодинамика
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным. Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
В окружающем нас мире энергия проявляется в виде механической работы, теплоты и внутренней энергии тела.?
Среди различных форм энергии, встречающихся в химических процессах, особое значение имеет внутренняя энергия U, которая находится в скрытом виде в каждом веществе и слагается из энергии поступательного, колебательного и вращательного движений элементарных частиц и энергии взаимодействия этих частиц.?
Количество внутренней энергии системы зависит не только от природы составляющих ее веществ и их массы, но и от состояния системы, т. е. от внешних условий, в которых она находится.
Из внешних условий, влияющих на величину внутренней энергии системы, следует учитывать объем V, давление р и температуру Т. Эти три переменных фактора определяют термодинамическое состояние системы и могут изменяться в любом физико-химическом процессе. Следовательно, U = f (V, р, Т).
Поскольку внутренняя энергия зависит от количества вещества, ее относят к молю этого вещества. Единицей же ее измерения обычно является тепловая единица — калория.?
Изменение внутренней энергии не зависит от пути перехода системы из одного состояния в другое, а определяется лишь параметрами начального и конечного состояний этой системы.
Формами превращения внутренней энергии при изменении состояния системы являются теплота и механическая работа. Изменение внутренней энергии может происходить за счет подвода к системе или отвода от нее тепла. Оно может явиться и результатом работы, совершенной самой системой или над ней.
Тепло: Q = q * t
где q – тепловой поток,
t – время.
варианты теплообмена системы с окружающим миром:
1. Если  , то это означает, что тепло к системе подводится.
, то это означает, что тепло к системе подводится.
2. Если  , аналогично — тепло отводится.
, аналогично — тепло отводится.
3. Если  , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Работа: A = F * Δs = p * ΔV
где F – сила,
Δs – перемещение,
p – давление,
ΔV – изменение объема.
Внутренняя энергия: ΔU = c * m * Δt,
где c – удельная теплоемкость,
m – масса материала.
Частные случаи проявления первого начала термодинамики:
- при изобарном процессе (р=const)
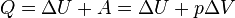
- при изохорном процессе (
 )
)
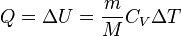
- при изотермическом процессе
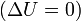
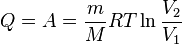
Здесь 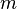 — масса газа,
— масса газа, 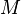 — молярная масса газа,
— молярная масса газа,  — молярная теплоёмкость при постоянном объёме,
— молярная теплоёмкость при постоянном объёме, 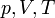 — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
— давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния: р, V и T.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 488; Нарушение авторских прав?; Мы поможем в написании вашей работы!