
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок выполнения работы. Химические основы фотометрического определения ионов железа (III) в виде роданидных комплексов
|
|
|
|
Химические основы фотометрического определения ионов железа (III) в виде роданидных комплексов
Ионы трехвалентного железа в кислой среде взаимодействуют с роданид-ионами и в зависимости от концентрации последних образуют ряд комплексов кроваво-красного цвета различного состава:
Fe3+ + nCNS– ↔ [Fe(CNS)n]3–n,
где n – число ионов роданида, связанных в железороданидный комплекс с координационным числом от 1 до 6.
В растворе всегда находится несколько комплексных соединений, т.к. невозможно создать условия существования в растворе какого-либо одного устойчивого железороданидного комплекса. Поэтому для получения воспроизводимых результатов необходимо:
1. Точно соблюдать равную концентрацию роданид-иона в испытуемом и стандартном растворах, так как только в этом случае можно получить одинаковую интенсивность окраски растворов;
2. Добавлять большой избыток роданида, так как при этом условии раствор в большом интервале концентраций железа подчиняется основному закону светопоглощения;
3. Измерять оптическую плотность раствора сразу после приготовления, так как его окраска неустойчива из-за восстановления ионов железа ионами роданида (раствор бледнеет).
Максимум светопоглощения железороданидного комплекса лежит в области 400–500 нм.Для определения концентрации ионов Fe3+ используют метод калибровочного графика
1.5.1 Приготовление растворов
Для построения калибровочного графика готовят серию стандартных растворов с различной концентрацией ионов Fe3+. Для этого рассчитывают, какой объем концентрированного стандартного раствора (С = 1 г/л) необходимо взять, для приготовления растворов в мерных колбах объемом 50 мл с концентрацией 1, 2, 3, 4, 5 мг/л. Расчет проводят следующим образом. Концентрация разбавленных растворов выражена в единицах мг/л, поэтому концентрация концентрированного раствора также следует перевести в единицы мг/л (1 г/л = 1000 мг/л). Масса растворенного вещества в концентрированном и разбавленном растворе остается постоянной, поэтому мы можем воспользоваться следующим соотношением:
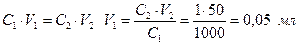
Таким образом, для приготовления 50 мл раствора с концентрацией 1 мг/л необходимо взять 0,05 мл стандартного раствора хлорида железа (III). Аналогично рассчитывают объемы концентрированного раствора, необходимые для приготовления остальных растворов.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Рассчитанные объемы отмеряют градуированной пипеткой объемом 1 мл и переносят в мерные колбы объемом 50 мл. В каждую колбу добавляют отмеренные цилиндром 5 мл соляной кислоты и 5 мл роданида аммония. После этого колбы доводят дистиллированной водой до метки и перемешивают. Для приготовления холостой пробы берут те же реактивы, но без хлорида железа. В данном случае все компоненты не имеют окраски и их можно заменить дистиллированной водой. Это будет раствор сравнения.
1.5.2 Измерение оптической плотности
Для всех растворов измеряют на фотоэлектроколориметре оптическую плотность. Для этого используют кюветы с l = 2–3 см, синий светофильтр №3 (λ = 400 нм). Каждое измерение повторяют три раза, полученные результаты заносят в таблицу 1.
Таблица 1 – Зависимость оптической плотности от концентрации ионов Fe3+
| Оптическая плотность | Концентрация растворов, мг/мл | |||||
| Сх | ||||||
| D 1 | ||||||
| D 2 | ||||||
| D 3 | ||||||
| D среднее |
1.5.3 Определение содержания ионов Fe3+ в анализируемом растворе
Проба анализируемого раствора выдается лаборантом в мерной колбе объемом 100 мл. Полученный анализируемый раствор доводят до метки дистиллированной водой. Отбирают градуированной пипеткой аликвотную часть (2–4 мл) и переносят в мерную колбу объемом 50 мл, добавляют цилиндром 5 мл раствора соляной кислоты и 5 мл раствора роданида аммония, доводят до метки дистиллированной водой и перемешивают. Полученный раствор фотометрируют 3 раза, результаты измерений заносят в таблицу 1.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 551; Нарушение авторских прав?; Мы поможем в написании вашей работы!