
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в гетеро-х системах
|
|
|
|
Зависимость константы равновесия от температуры.
Изменение константы равновесия можно найти из уравнения Гиббса-Гельмгольца: 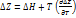
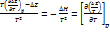 (1) Подставим значение
(1) Подставим значение 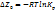 ;
; 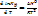 (2) уравнение изобары. Знак производной определяется знаком теплового эффекта. В случае эндотермической реакции константа равновесия растет с увеличением температуры, а для экзотермической уменьшается с с увеличением тем-ры. Выразим константу равновесия через концентрацию
(2) уравнение изобары. Знак производной определяется знаком теплового эффекта. В случае эндотермической реакции константа равновесия растет с увеличением температуры, а для экзотермической уменьшается с с увеличением тем-ры. Выразим константу равновесия через концентрацию  (3) уравнение изохоры. Из (2) и (3) следует соединения образованные с поглощением тепла при высоких температурах становятся более устойчивыми, а экзотермические прочны при низких температурах. Для того чтобы проинтегрировать 2 и 3 примем что ∆H не зависит от тем-ры:
(3) уравнение изохоры. Из (2) и (3) следует соединения образованные с поглощением тепла при высоких температурах становятся более устойчивыми, а экзотермические прочны при низких температурах. Для того чтобы проинтегрировать 2 и 3 примем что ∆H не зависит от тем-ры: 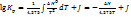 (4) Уравнение (4) показывает что между
(4) Уравнение (4) показывает что между  и обратной тем-рой прямолинейная зависимость.
и обратной тем-рой прямолинейная зависимость.
Системы, в состав которых входит более одной фазы, называются гетерогенными. Они могут содержать газовую фазу, а также конденсированные фазы - твердые или жидкие. Рассмотрим случай, когда все участвующие в реакции конденсированные фазы представляют собой вещества, которые не образуют друг с другом растворов, и, таким образом, только газовая фаза может быть раствором. К числу таких реакций относятся:
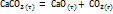 ;
;

В общем виде для гетерогенной реакции Aг + Вк = Dк + 2Eг (индекс "к" означает конденсированную фазу) условие равновесия при постоянных темпер-е и давлении состоит в равенстве нулю алгебр-ой суммы свободных энергий Гиббса всех участвующих в реакции веществ: 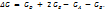
Уравнение состояния идеальных газов применимо лишь в том случае, если можно пренебречь собственным объемом молекул газа. Поэтому при использовании законов идеальных газов для расчетов гетерогенных равновесий можно пренебречь объемом конденсированных фаз ввиду его малости. Отсюда следует, что энергия Гиббса веществ, находящихся в твердом или жидком состоянии, практически не зависит от давления. Таким образом, для рассматриваемой реакции:
|
|
|

Преобразуя, получим: 
Это означает выраж-е для закона действующих масс для гетерогенных систем остается таким же, как и для гомогенных систем, но только парциальные давления (или концентрации) конденсир-ых фаз не входят в уравнение константы равнов-я. Изменение свободной энергии Гиббса при рассмотренной выше гетерогенной реакции Aг + Вк составляет: 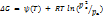
Константы равновесия ряда реакций не могут быть эксперим-но определены из-за весьма малых величин парциальных давлений (или концентраций) некоторых из компонентов
16. 3 закон термодинамики.
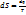 – энтропия. На основании 1 и 2 з-а термод. невозможно определить абсол. знач. S. Такое невозможность отражается и на уравнениях, из к-х могут быть условия равновесия реакции. Поэтому вычисл. величин
– энтропия. На основании 1 и 2 з-а термод. невозможно определить абсол. знач. S. Такое невозможность отражается и на уравнениях, из к-х могут быть условия равновесия реакции. Поэтому вычисл. величин 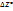 или Kр не могут быть доведены до численных значений, несмотря на то, что темп-ая зависимость ∆H(T),
или Kр не могут быть доведены до численных значений, несмотря на то, что темп-ая зависимость ∆H(T),  определяется из термич.величин.
определяется из термич.величин.
Z=F+PV=U-TS+PV=H-TS => что Т→0, 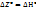 , т.к.
, т.к. 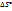 при реакции не может быть бесконечностью.
при реакции не может быть бесконечностью.
Для того чтобы определить положение кривой надо знать постоянное интегрирование. Эта величина определяется эмпирическим путем, если известна 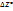 , Кр.
, Кр.
При низких темп-ах все тела переходят в вырожденные состояния, при к-м св-ва тел не зависят от темп. При приближении к абсол. нулю все термич. коэф. равны 0. Это явление получает свое назв. только при изучении квант. механики. Явл-е вырождения наблюдается у всех тел, а стало быть дает телам общее св-во.
 Первое утверждение 3 з-на термод.: при Т→0 СР и СV → 0. Это соотв-ет тому, что внутр. эн-я и энтольпия не зависят от темп. Такое утверждение основывается на многих измерениях при низких темп-ах.
Первое утверждение 3 з-на термод.: при Т→0 СР и СV → 0. Это соотв-ет тому, что внутр. эн-я и энтольпия не зависят от темп. Такое утверждение основывается на многих измерениях при низких темп-ах.
|
|
|
Второе утверждение 3 з-на термод.: S простых крист. форм → 0. S может достигнуть нулевого знач., лишь при условии если СР→0. 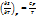
 ; Если CV→0 при СР→0 => S=
; Если CV→0 при СР→0 => S= 
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 324; Нарушение авторских прав?; Мы поможем в написании вашей работы!