
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач
|
|
|
|
1. В сосуде объёмом 3 м3 находится смесь 7 кг азота и 2 кг водорода при температуре 27°С. Определить давление и молярную массу смеси газов.
Дано: V = 3 м3; m1 = 7 кг; m2 = 2 кг; μ1 = 28×10-3 кг/моль;
μ2 = 2×10-3 кг/моль; Т = 300 К.
Найти: р, μ.
Решение: Воспользуемся уравнением Менделеева-Клапейрона, применив его к азоту и водороду:
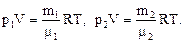
| (1) |
В этих уравнениях р1, р2 – парциальные давления азота и водорода, μ1, μ2 – молярные массы азота и водорода,
R = 8,31 Дж/моль×К – универсальная газовая постоянная. По закону Дальтона,
| р = р1+ р2. | (2) |
Из уравнений (1) выразим р1 и р2 и подставим в (2):

| (3) |
С другой стороны,

| (4) |
Сравнивая выражения (3) и (4), получим:
 откуда
откуда
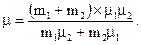
| (5) |
Подставляя в выражение (5) числовые данные, получим:
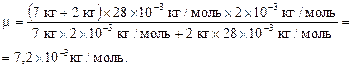
Подставляя числовые данные в выражение (4), получим: 
Ответ: 1,04 МПа; 7,2×10-3 кг/моль.
2. Чему равны средние кинетические энергии поступательного и вращательного движения молекул, содержащихся в 4 кг кислорода при температуре 200 К?
Дано: m = 4 кг; Т = 200 К; μ = 32×10-3 кг/моль.
Найти: <Епост>, <Евращ>.
Решение: Считаем кислород идеальным газом. Молекула кислорода двухатомная, связь между атомами считаем жёсткой, тогда число степеней свободы молекулы кислорода равно 5. в среднем на одну степень свободы приходится энергия 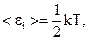 где k − постоянная Больцмана. Поступательному движению приписывается три, а вращательному две степени свободы. Тогда энергия одной молекулы равна:
где k − постоянная Больцмана. Поступательному движению приписывается три, а вращательному две степени свободы. Тогда энергия одной молекулы равна:
 <εвращ> = kT.
<εвращ> = kT.
Число молекул, содержащихся в массе газа:

где NА – число Авогадро. Тогда средняя кинетическая энергия поступательного движения молекул кислорода равна:

| (1) |
где R = NA × k.
Средняя кинетическая энергия вращательного движения молекул кислорода равна:
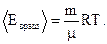
| (2) |
Подставляя числовые значения в формулы (1) и (2), имеем:


Ответ: 3,12×105 Дж; 2,08×105 Дж.
3. Определить среднюю длину свободного пробега молекул и число соударений за 1 с, происходящих между всеми молекулами водорода, находящегося в сосуде ёмкостью 1 л при температуре 27°С и давлении 10 кПа.
Дано: V = 1 л = 1×10-3 м3; μ = 2×10-3 кг/моль; Т = 300 К;
р = 1×104 Па; d = 2,3×10-10 м.
Найти: <λ>, Z.
Решение: Средняя длина свободного пробега молекул водорода равна:

| (1) |
где d − эффективный диаметр молекулы водорода, n – концентрация молекул, которую можно определить из уравнения 
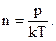
| (2) |
Подставляя (2) в (1), имеем:

| (3) |
Число соударений Z, происходящих между всеми молекулами за 1 с, равно:
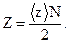
| (4) |
В формуле (4) <z> − среднее число соударений одной молекулы за 1 с, N − число молекул водорода в сосуде объёмом 1 л. Число молекул в сосуде
| N = n × V. | (5) |
Среднее число соударений молекулы за 1 с равно:

| (6) |
где <v> − средняя арифметическая скорость молекулы.
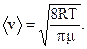
| (7) |
Подставляя в (4) выражения (5), (6) и (7), находим:
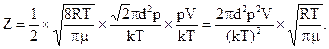
Подставляя числовые данные, получим:
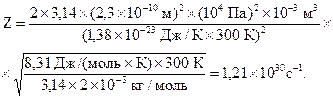
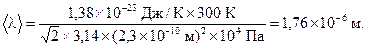
Ответ: 1,76×10-6 м; 1,21×1030 с-1.
4. Определить коэффициенты диффузии и внутреннего трения гелия, находящегося при температуре 200 К и давлении 104 Па.
Дано: μ = 4×10-3 кг/моль; Т= 200 К; р = 104 Па; d = 1,9×10-10 м.
Найти: D, η.
Решение: Коэффициент диффузии находят по формуле:
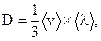
| (1) |
где <v> − средняя арифметическая скорость молекул, равная:

| (2) |
<λ> − средняя длина свободного пробега молекул.
Для нахождения <λ> воспользуемся формулой, взятой из решения примера 3:

| (3) |
Подставляя (2) и (3) в (1), получим:

| (4) |
Коэффициент внутреннего трения равен:

| (5) |
Здесь ρ – плотность газа при данных условиях.
Для нахождения ρ воспользуемся уравнением состояния идеального газа (уравнением Менделеева-Клапейрона):

| (6) |
Учитывая, что  имеем:
имеем:
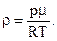
| (7) |
Коэффициент внутреннего трения газа может быть выражен через коэффициент диффузии:
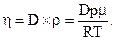
| (8) |
Подставляя числовые значения в формулы (4) и (8), получаем:
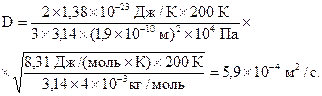
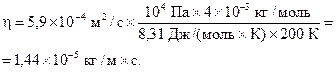
Ответ: 5,9×10-4 м2/с; 1,44×10-5 кг/м×с.
5. Кислород массой 320 г нагревают при постоянном давлении от 300 до 310 К. определить количество теплоты, поглощённой газом; изменение внутренней энергии и работу расширения газа.
Дано: m = 320 г = 0,32 кг; Т1 = 300 К; Т2 = 310 К; μ = 32×10-3 кг/моль.
Найти: Q, ΔU, A.
Решение: Количество теплоты, необходимое для нагревания газа при постоянном давлении, равно:
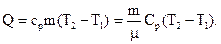
| (1) |
Здесь cp, Cp – удельная и молярная теплоёмкости газа при постоянном давлении. Для всех двухатомных газов с жёсткой связью  ,
, 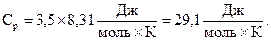
Изменение внутренней энергии газа равно:
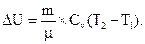
| (2) |
Здесь Cv –молярная теплоёмкость газа при постоянном объёме. Для всех двухатомных газов с жёсткой связью
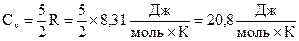 .
.
Работа расширения газа при изобарном процессе: А= p×ΔV, где ΔV= V2 – V1 – изменение объёма газа, который можно найти из уравнения Менделеева – Клапейрона:
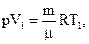
| (3) | 
| (4) |
Вычитанием выражения (4) из выражения (3) находим:

следовательно,

| (5) |
Подставляя числовые данные в формулы (1), (2) и (5), получим:
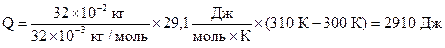
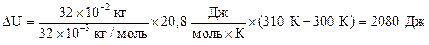
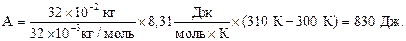
Ответ: 2910 Дж; 2080 Дж; 830 Дж.
6. Объём аргона, находящегося при давлении 80 кПа, увеличился от 1 до 2 л. Насколько изменится внутренняя энергия газа, если расширение производилось: а) изобарно; б) адиабатно?
Дано: V1= 1 л = 10-3 м3; V2= 2 л = 2×10-3 м3; р = 0,8×105 Па;
μ = 40×10-3 кг/моль.
Найти: ΔU.
Решение: Применим первый закон термодинамики. Согласно этому закону, количество теплоты Q, переданное системе, расходуется на увеличение внутренней энергии ΔU и на внешнюю механическую работу А:
| Q = ΔU + A. | (1) |
Здесь

| (2) |

| (3) |
где i – число степеней свободы.
Тогда выражение (2) примет вид:

| (4) |
Запишем уравнение Менделеева – Клапейрона для начального и конечного состояний газа при изобарном процессе:
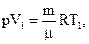

Имеем после вычитания:

| (5) |
Подставив (5) в (4), получим:
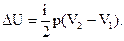
| (6) |
При адиабатном расширении газа теплообмена с внешней средой не происходит, поэтому Q = 0. Уравнение (1) запишем в виде:
| ΔU + A = 0. | (7) |
Это соотношение устанавливает, что работа расширения газа может быть произведена только за счёт уменьшения внутренней энергии газа (знак минус перед ΔU):
| A = −ΔU. | (8) |
Работа, совершённая газом при адиабатном процессе, равна:

| (9) |
Здесь γ = Сp/Cv = (i+2)/i − показатель степени адиабаты. Для аргона (одноатомного газа) i = 3, имеем: γ = 1,67.
Найдём изменение внутренней энергии при адиабатном процессе для аргона, учитывая формулы (8) и (9):
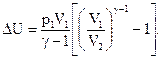
| (10) |
Подставляя числовые значения в (6) и (10), получаем:
а) при изобарном расширении

б) при адиабатном расширении

Ответ: 120 Дж; − 44,6 Дж.
7. Температура нагревателя тепловой машины 450 К. Температура холодильника 300 К. Определить КПД тепловой машины, работающей по циклу Карно и полную мощность машины, если нагреватель ежесекундно передаёт ей 1525 Дж теплоты.
Дано: Т1 = 450 К, Т2 = 300 К, Q = 1525 Дж, t = 1 с.
Найти: η; N.
Решение: КПД машины равен:
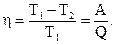
| (1) |
Из выражения (1) находим:
 .
.
Произведём вычисления:
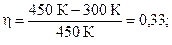
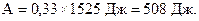
Эта работа совершается за 1 с, следовательно, полная мощность машины равна:

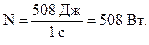
Ответ: 0,33; 508 Вт.
8. Горячая вода некоторой массы отдаёт теплоту холодной воде такой же массы, и температуры их становятся одинаковыми. Показать, что энтропия при этом увеличивается.
Дано: Т1 – температура горячей воды, Т2 – температура холодной воды, θ − температура смеси. Показать, что: ΔS > 0.
Решение: Температуру смеси определим из уравнения теплового баланса:
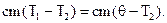
Отсюда 
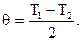
| (1) |
Изменение энтропии, происходящее при охлаждении горячей воды:
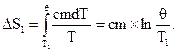
Изменение энтропии, происходящее при нагревании холодной воды:

Изменение энтропии системы:
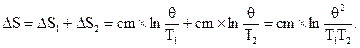
С учётом соотношения (1) имеем:

Так как  то ΔS>0.
то ΔS>0.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 3326; Нарушение авторских прав?; Мы поможем в написании вашей работы!