
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
L-аланин D-аланин
|
|
|
|
COOH COOH
│ │
H2N- Cα – H H - Cα – NH2
│ │
CH3 СН3
 |
Рис. 2. Графические формулы L- и Д-аланина.
Форма конфигурации имеет значение, так как ферменты оказывают действие лишь в том случае, если молекула находится в определенной конфигурации. Такая специфичность определяет то, что белки обычно целиком состоятиз L- аминокислот.
Все малые молекулы имеют свойства, обеспечивающие их способность к полимеризации: они содержат не менее двух химических групп, способных реагировать друг с другом с образованием ковалентной связи.
Основную массу клетки (за исключением воды) составляют крупные углеродсодержащие молекулы, или макромолекулы, число атомов в которых в 25-30 раз больше, чем в малых молекулах.
Все макромолекулы являются биополимерами и образуются путем соединения более мелких молекул – мономеров в линейные структуры прочными ковалентными связями. Синтез сопровождается выделением молекул воды (дегидратацией), но этот процесс является сложным, идущим в присутствии ферментов и не сводится к простому отщеплению воды.
К биополимерам относятся белки, нуклеиновые кислоты и некоторые полисахариды. Мономерами биополимеров являются разные химические группировки: аминокислоты – в белках, нуклеотиды – в нуклеиновых кислотах и моносахара – в полисахаридах. Линейная струк-
тура полимеров представляют собой макромолекулу, построенную из повторяющихся одинаковых мономеров в, так называемый, остов молекулы. Мономеры, соединяются: в белках – пептидной связью, в нуклеиновых кислотах - 3'-5'- фосфодиэфирной связью, в полисахаридах – 1,4- гликозидной связью.
Полимеры могут быть регулярными или нерегулярными. Регулярные полимеры содержат один (редко два) типа мономеров (полисахариды). Нерегулярные полимеры содержат 4 типа мономеров (нуклеиновые кислоты) или 20 типов (белки), кроме того, порядок расположения мономеров в нерегулярных полимерах сильно различается у разных молекул.
Синтез нерегулярных полимеров носит матричный характер и требует участия специального механизма, обеспечивающего выбор и размещение мономеров в полимере.
Глава. 2. Информационные макромолекулы
Белки и нуклеиновые кислоты – это биополимеры, которые обеспечивают хранение, передачу и реализацию генетической информации в живом организме и, следовательно, все жизненные проявления в живой системе, поэтому их относят к информационным макромолекулам.
Часть I. Глава 3. Белки
Белки - органические соединения, высокомолекулярные природные биополимеры. Белки составляют около половины массы сухих веществ клетки. Видовой состав белков живого организма очень высок: в клетке находятся сотни различных видов этих макромолекул.
В состав белков входят следующие элементы: углерод (50-54%), азот (15-18%), кислород (20-23%), водород (6-8%) и сера (до 2,5%). Таким образом, большую часть массы белков составляют углерод, азот, кислород и водород. Это объясняется тем, что:
1. Все 4 элемента легко образуют ковалентные связи;
2. Они самые легкие среди элементов, поэтому ковалентные связи являются очень сильными, так как их прочность обратно пропорциональна атомным массам элементов;
3. Углерод, азот и кислород образуют и одинарные и двойные свя- зи, что обеспечивает разнообразие свойств белка;
4. Углерод в белках образует каркасы разных форм и конфигураций: ответвления и трехмерные структуры.
Белки также называют протеинами, подчеркивая этим важное значе- ние этого класса соединений. Термин предложен Барцелиусом в 1838г. и оз- начает первостепенный (греч. proteios)
3.1. Аминокислоты – мономеры белка
Мономерами белков являются аминокислоты. Всего в природе найденооколо 300 аминокислот, однако в состав белков входит лишь 20, называемых белковыми или протеиновыми.
Белковые аминокислоты являются α-аминокислотами, имеющи- ми общий план строения: центральный углерод (α-углерод) соединен с карбоксильной (-СООН) и амидной (-NH2) группами, водородом и радика- лом. Различия между аминокислотами определяют радикалы
R
│
H2 N — Сα — СООН
│
H
Радикалы (боковые группы) аминокислот различаются по структуре, электрическому заряду и растворимости, обеспечивая свойства аминокис- лот. В зависимости от способности растворятся в воде, аминокислоты делятся на неполярные (гидрофобные) и полярные (гидрофильные) (рис.3; табл.2).
У неполярных аминокислот электроны радикалов равномерно рас- пределены между атомами (CH4). Неполярные радикалы аминокислот (гидрофобные) имеют алифатические радикалы, то есть, радикалы, у которых атомы углерода соединены в прямые или разветвленные, но не замкнутые цепи (аланин, валин, лейцин, изолейцин, пролин и метионин) и ароматические кольца (фенилаланин и триптофан). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается, следовательно, они полностью нерастворимы в воде.
У полярных аминокислот возникает дипольный момент из-за неравномерного распределения зарядов между атомами молекулы; в результате на одних атомах имеется небольшой несбалансированный положительный, на других – отрицательный заряды (молекула Н2О). Полярные аминокислоты делятся на полярные с незаряженными радикалами, и полярные с радикалами, заряженными положительно или отрицательно.
Полярные незаряженные радикалы растворяются в воде, т.к. в их состав входят полярные функциональные группы, образующие водородные связи с водой. К аминокислотам, имеющим в своем составе
Таблица 2.
Классификация основных аминокислот белков по их химическому
 строению
строению

 |
Рис.3. Графические формулы 20 наиболее часто встречаемых радикалов
(Из: Рис, Стернберг, 1988)
такие радикалы, относятся серин, треонин, тирозин, имеющие гидроксильные группы (СООН), аспарагин и глутамин, содержащие амидные группы (СО - NH2) и цистеин с его тиольной группой (SH-группа) (при рН около 7,0 практически не диссоциируют).
Полярные отрицательно заряженные радикалы имеют дополни- тельную карбоксильную группу, которая при рН около 7,0 (рН нормально функционирующий клетки) диссоциирует с образованием СО- и Н+. Следовательно, эти радикалы являются анионами и они входят в состав глутаминовой и аспарагиновой кислот. Ионизированные группы этих аминокислот называются, соответственно, глутаматом и аспартатом.
Полярные положительно заряженные радикалы имеют допол- нительную заряженную группу: вторая аминогруппа (-NH2), способная присоединять Н+ у лизина, гуанидиновая группа, приобретающая поло- жительный заряд у аргинина, и 6,9-имидазольная группа у гистидина, которая при колебании рН от 7,4 способна присоединять протон, теряя положительный заряд в зависимости от концентрации протонов (Н+) и гидроксильных групп (ОН¯) в среде. Таким образом, гистидин становится либо катионом, либо нейтральной аминокислотой.
Полярные заряженные радикалы обладают наибольшей растворимостью в воде.
Таким образом, характеризуя аминокислоты (табл.2), следует подчеркнуть следующие моменты:
1 - аминокислоты существуют преимущественно в форме биполярных ионов;
2 - аминокислоты ассиметричны и образуют две изомерные формы: D и L (напомним, что белки состоят обычно из L-аминокислот, за исключением глицина, который не имеет изомерных форм); L-формы аминокислот могут переходить в D-формы. Этот переход называется рацемизацией. L-форма аспартата дентина эмали у млекопитающих может переходить в D-форму со скоростью 0,01% в год; таким образом, по содержанию D-формы аспартата дентина эмали можно определить возраст человека;
3 -аминокислоты отличаются друг от друга химической структурой боковых групп - радикалов. Они выступают из основной цепи и формируют поверхность полимера, определяя химические и физические свойства белков (рис.3):
а - алифатические аминокислоты выступают в роли связующего звена в цепи белка (глицин), а также важны для гидрофобной стабилизации белка и формирования центров связывания ферментов;
б - гидроксиаминокислоты за счет ОН-группы имеют слабокислые свойства; способны к образованию эфиров фосфорной и органических кислот и служат местом присоединения сахара в гликопротеидах;
в - дикарбоксильные аминокислоты находятся в диссоциированном состоянии при нейтральном рН и обеспечивают присутствие отрицате- льного заряда на поверхности белка;
г - амиды дикарбоксильных кислот полярные и участвуют в образова- нии водородных связей;
д - серосодержащие аминокислоты (в частности цистеин) обеспечива- ют образование дисульфидной (S-S) связи в результате самопроизвольного окисления с образованием двойной аминокислоты цистина и формированию поперечных –S-S-связей между пептидными цепями (рис.4);
е - основные аминокислоты с катионообразующими группами ради- калов несут положительный заряд, составляют часть активного центра многих ферментов и могут связывать ионы металлов;
ж - иминокислота (пролин): его боковая цепь замыкается на амино- группу, что придает ей жесткую конформацию. Присутствие пролина оказывает существенное влияние на характер пространственной кон- формации полипептида (рис.5);


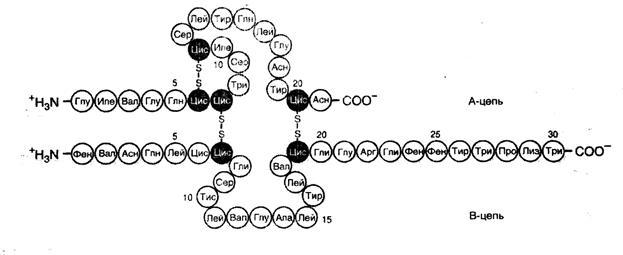
Рис.4. Дисульфидные связи в структуре белка (на примере инсулина)(Из:
Северин.2007)

Рис.5. Графическая формула аминокислоты пролина
4 -ароматические аминокислоты имеют легко диссоциирующие про- тоны, доноры протонов в водородных связях и функциональная группа в ферментативном катализе. Образуют гидрофобные связи и легко связываются с другими молекулами;
5 - алифатические аминокислоты: аланин, валин, лейцин, изолейцин, пролин, метионин, фенилаланин, триптофан являются неполярными (гидрофобными). Их радикалы в воде стремятся друг к другу или к другим гидрофобным молекулам; поверхность их соприкосновения с водой уменьшается;
6 - серин, треонин, тирозин (с -ОН группой в радикале), аспарагин, глутамин (с амидной группой в радикале) и цистеин (с тиольной группой) являются полярными незаряженными. Их радикалы растворяются в воде лучше, чем гидрофобные связи с водой;
7 - аспарагиновая и глутаминовая кислоты (имеют в радикале допол- нительную карбоксильную группу, диссоциирующуюся на СОО- и Н+) являются полярными отрицательно заряженными с радикалами анионами, а лизин, аргинин, гистидин - полярными положительно заряженными с радикалами катионами и обладают высокой степенью растворения в воде.
Свойства белков определяются этим разнообразием стандартных аминокислот.
Кроме 20 основных аминокислот у некоторых белков встречаются редкие (модифицированные) аминокислоты, которые образуются из про- теиновых, после их включения в состав белковой молекулы. Модификация заключается в введении дополнительных функциональных групп в струк- туру аминокислот и придает белкам свойства необходимые для выполнения специфичных функции (табл.3). Например, в коллагене содержатся 4-гидроксипролин и 5-гидроксилизин, производные пролина и лизина. Гидроксилирование (введение гидроксильной группы) пролина и лизина необходимо для стабилизации тройной спирали и фибриллы коллагена и требует присутствия витамина С, дефицит которого (цинга) приводит к нарушению гидроксилирования и образованию менее прочных коллагеновых волокон. Это вызывает хрупкость и ломкость сосудов и, как следствие, кровоточивость десен и выпадение зубов. Тироксин (Т4), трийодтиронин (Т3) входят в состав гормонов щитовидной железы, и являются иодированными производными тирозина; цистин образуется при окислении двух тиогрупп цистеиновых остатков, с образованием дисульфидного мостика; играет важную роль в образовании иммуноглобулинов, инсулина; γ-карбоксиглутаминовая кислота содержит дополнительную - СОО-группу, что обеспечивает максимальное связывание ионов Са²+ белком плазмы крови тромбином для его активации в процессах свертывания крови. В случае дефицита витамина К модификация глутаминовой кислоты (ее карбокси- лирование) не происходит, γ-карбоксиглутаминовая кислота не образуется, что замедляет процесс свертывания крови.
Кроме основных протеиновых 20 аминокислот в состав белков могут входить и другие аминокислоты (рис.6). Так, в состав ряда каталитически активных белков (глицин-редуктаза, глутатион-пероксидаза и др.) всех организмов от архибактерий до человека обнаружена аминокислота селеноцистеин, которая является редкой, но функционально важной. В связи с этим она названа 21-й белковой аминокислотой. В белках рибонуклеиновых комплесов выделена аминолимонная аминокислота (Франкфуртский университет, Германия). Она обнаружена в клетках организмов разного систематического положения; бактерий, тимуса теленка, селезенки коровы и человека. Функции ее не выяснены. Процесс включения таких аминокислот в состав белков имеет свои особенностии называется перекодирование трансляции.

 Н Н2N – СН - СООН
Н Н2N – СН - СООН
│ │
Н2N ― С ― СООН СН2
│ │
Н ― С ― СООН SeH
│
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 5317; Нарушение авторских прав?; Мы поможем в написании вашей работы!