
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пептидная связь
|
|
|
|

Рис.7. Схема образования пептидной связи
Пептидная связь характеризуется следующими свойствами:
1. 4 атома пептидной связи лежат в одной плоскости (рис.7а);
2. Атомы -О- и -Н- пептидной связи имеют трансориентацию;
3. Длина С-N-связи имеет частично двойной характер, поэтому она короче, чем другие связи пептидной цепи и малоподвижна. Вращение вокруг оси С-N практически невозможно, что связано с особенностями электронного строения связи.

Рис.7а. Стереометрическая модель пептидной связи
4. Пептидные связи обычно располагаются в транс-конфигурации ( рис.8 ), то есть, α-углеродные атомы располагаются по разные стороны цепи и боковые радикалы расположены на значительном расстоянии друг от друга. Иногда встречается цис- конфигурацияпептидных связей, в которой α-углеродные атомы располагаются по одну сторону цепи пептида (чаще всего она образуется при атоме азота пролина).
5. Пептидные связи очень прочные и самопроизвольно не разрыва- ются; в живых организмах разрыв пептидных связей осуществляют специальные протеолитические (lysis- разрушение) ферменты - протеазы или пептидгидролазы.
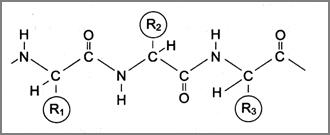 |
Рис.8. Транс-конфигурация пептидной связи
Соединения, в которых аминокислоты соединены пептидными связя- ми, называется пептидами. В зависимости от молекулярной массы они делятся на олигопептиды (содержат до 10 аминокислот), полипептиды (до 100 аминокислот) и белки (свыше 100 аминокислот). Но такая класси- фикация условна: в литературе термин белок употребляется иногда для обозначения полипептидов, содержащих менее 50 аминокислотных остатков Например, глюкагон – гормон, состоящий из 29 аминокислотных остатков, называют белковым гормоном.
Так как, в ходе полимеризации каждая аминокислота теряет молекулу H2O, то мономеры полипептида называют аминокислотными остатками. Вкаждом полипептиде на одном конце имеется аминокислотный остаток со свободной аминогруппой (-NH2) и называется N-концевым, а на другом – со свободной карбоксильной группой (-СООН) и называется C-концевым ( рис.9 ).
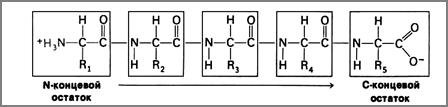 |
Рис. 9. Схематическое изображение пептидной связи
(стрелкой показано направление образования пептидной связи)
Пептиды пишутся, читаются и нумеруются с N-конца; аминокислотные остатки обозначаются символами. Например:
Аla-Tyr-Ley-Ser-……….-Cys
При чтении такой записи окончания названий всех аминокислотных остатков, кроме последней, изменяется на –ил– например: аланил-лейцил-серил-тиразил….цистеин.
Цепь повторяющихся атомов в полипептидной цепи –NH-CH-CО – называется полипептидный остов.
Изучение строения аминокислот и продуктов гидролиза белков позволило немецкому химику Э. Фишеру (1852-1919) создать пептидную теорию строения белка, согласно которой белки является линейными полимерами α-аминокислот, соединенных пептидной связью; разнообразие белков объясняется различиями количества аминокислотных остатков и порядком их чередования в цепи полимера.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислотных остатков. Идентичные по длине и аминокислотному составу пептиды могут быть разными веществами. Например: из аминокислот аланин и тирозин можно построить два разных пептида: Аlа-Tyr и Tyr- Аlа; из трех аминокислот можно получить 6 различных по строении и свойствам пептидов; из 20 аминокислот - 2·1018 пептидов. Если учесть, что каждая аминокислота может в цепи повторяться, то возможность составления разных белков из аминокислот будет также неисчерпаема, как и возможность составления фраз из букв алфавита. Белки с одинаковым составом аминокислот, но с разной их последовательностью в цепи называется структурными изомерами. В живой природе реализуются не все возможности структурной изомерии. По приблизительным подсчетам число белков в организме человека составляет около 50 тысяч разных белков.
Аминокислоты, соединяясь пептидными связями, образуют линейныйбиополимер с определенной их последовательностью. Порядок чередования α-аминокислот в линейном полимере называется первичной структурой пептидов и белков и закодирован в участке ДНК, называемом геном. Все молекулы белка имеют определенную первичную структуру. Даже ее незначительные изменения могут стать причиной болезни. Например, если заменить в молекуле нормального гемоглобина (НвА) эритроцитов здорового человека глютаминовую аминокислоту в 6 положении на амино- кислоту валин, то образуется гемоглобин Ѕ (НвЅ), который приведет к возникновение болезни серповидноклеточной анемии.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2746; Нарушение авторских прав?; Мы поможем в написании вашей работы!