
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция тезистері
|
|
|
|
№1 дәріс
Тақырыбы: Молекулалық биологияның қысқаша даму тарихы
Жоспары: 1.молекулалық биологияның қысқаша тарихы
2. молекулалық биологиялық зерттеу әдістері және олардың
медицина үшін маңызы
Молекулалық биология-тіршілікті молекулалық деңгейде зерттейтін кешенді биология ғылымының маңызды саласының бірі.
Молекулалық биология ғылымының негізгі зерттеу объекттері — жасушаның ақпараттық макромолекулалары-ақуыз және нуклеин қышқылдары болып саналады. Ол ақпараттық макромолекулалардың құрылысын, қызметтерін, таралуын зерттейді.
Қазіргі таңда молекулалық биология жедел дамып келе жатқан ғылым ретінде теориялық және қолданбалы биология, генетика, медицина, ауылшаруашылығы т.б. ғылымдардың дамуында маңызды рөл атқарады. XXІ ғасырды молекулалық биология ғасыры деп атауда.
Молекулалық биология ғылымы бірнеше бөлімдерге бөлінеді: геномика тұқым қуалаушылықтың материалдық негіздері-ДНҚ, РНҚ молекулаларының құрылыстарын, қызметтерін зерттейді; протеомика — жасуша ақуыздарының құрылысын, қызметтерін зерттейтін бөлім.
Геномика ғылымының негізгі міндеті мен мақсаты - адам және басқа да тірі ағзалардың геномдарының құрылысын, қызмет ету тетіктерін зерттеп, анықтап, анықталған деректерді, білімдерді адам өмірінің сапасын жақсартуға пайдалану болып табылады.
Молекулалық биология ғылымының дербес ғылым ретінде қалыптасуы 1953 жылдан кейін басталды, себебі осы жылы Ф.Крик және Дж. Уотсон дезоксирибонуклеотид қышқылының (ДНҚ) қос ширатпалы құрылысын анықтап, оның моделін кұрастырған.
Соңғы 50-55 жыл ішінде молекулалық биология ғылымы тіршіліктің сырларын зерттеуде көптеген маңызды жетістіктерге қол жеткізді.
XX ғасырдың 40-50 жылдары ғалымдардың зерттеулері нәтижесінде тұқым қуалаушылықтың материалдық негізі нуклеин қышқылдары екендігі белгілі болды (О.Эйпери, К.Мак Леод, М.Мак Карти; Н.Циндер, Д.Ледерберг; Х.Френкель-Конрат т.б.)
1954 жылы американ ғалымы Г.Гамов тұқым қуалаушылық ақпарат ДНҚ молекуласында генетикалық код күйінде жазылған, генетикалық код 3 нуклеотидтен тұруы мүмкін деген болжам жасады. Ал, 1961-1964 жылдары Ф.Крик, Х.Корана, М.Ниренберг, С.Очао т.б. ғалымдардың еңбектері нәтижееінде генетикалық кодтың толық сөздігі анықталды.
1961 жылы француз ғалымдары Ф.Жакоб және Ж.Моно прокариоттар гендерінің экспрессиялануының оперондық гипотезасын ұсынды. Кейінірек гендердің экспрессиялану тетіктері (механизмі) прокариоттарда да, эукариоттарда да бірдей жоба күйінде болатындығы белгілі болды (Г.П.Георгиев).
XX ғасырдың жетпісінші жылдары кері транскриптаза (ревертаза) ферменті ашылып тұқым қуалаушылық ақпараттың РНҚ-дан (ретровирустардан) ДНҚ-ға берілу жолы белгілі болды, осылайша жасушада ақпараттың берілуінің негізгі бағыттары анықталды:
-ақпараттың берілуінің жалпы жолы-ДНҚ-ДНҚ-РНҚ-ақуыз, яғни биологияның (Криктің) негізгі постулаты;
-ақпараттың ерекше берілу жолы-РНҚ-ДНҚ-ДНҚ-РНҚ-ақуыз, яғни ақпараттың берілуінің ерекше жолы.
1970-1980 жылдары белгілі бір нуклеотидтер (сайттар) арасын үзіп, ДНҚ молекуласын бөлек-бөлек үзінділерге қиятын «қайшылар»-рестриктаза ферменттері және ДНҚ үзінділерін бір-біріне жалғап тігетін «инелер»-лигаза ферменттері ашылып, генетикалық инженерияның дамуына жол ашылды. Генетикалық инженерия жетістіктері негізінде көптеген трансгендік ағзаларды (өсімдіктер, жануарлар, микроағзалар) дүниеге келтіріп, адамға қажетті кейбір биологиялық белсенді заттарды (соматотропин, инсулин, интерферон т.б.) зертханалық жағдайларда биотехнологиялық жолмен өндіруге мүмкіндік туды.
XX ғасырдың 90 жылдары жоғары сатылы диплоидты ағзаларды клондау тәжірибелері сәтті аяқталып, 1997 ж. Ұлыбританияда «Долли» атты қозы, 1998 ж. торай, ал 1999 ж. маймыл баласы дүниеге келді.
2001-2003 жылдары «Адам геномы» атты халықаралық ғылыми бағдарлама толық аяқталып, 2001 жылдан кейін адамзат постгеномдық дәуірге аяқ басты.
Молекулалық биологияның дамуына көптеген орыс және қазақ ғалымдары ат салысты, олардың арасынан А.А.Баев, А.Н.Белозерский, А.Е.Епирин, ВАЭнгельгард, А.П.Георгиев, ТДарханбаев, М.А.Айтхожин, Х.Жуматов т.б. есімдерді атауға болады.
Молекулалық –биологиялық зерттеу әдістері және олардың медицина үшін маңызы
Цитогенетикалық әдістердің мәні-микроскоп арқылы адам хромосомаларын зерттеу болып табылады. Бұл әдіс ХІХ ғ. аяғынан қолданылып келеді. Цитогенетикалық әдістер арқылы-хромосома санының не жеке хромосомалардың құрылымын жарық микроскоп арқылы зерттейді. Цитогенетикалық зерттеулер обьекті-бөлінуші (митоз, мейоз) не интерфазалық жасушалар болып табылады.
Молекулалық-цитогенетикалық әдістер-хромосомаларды зерттеудегі жаңа әдіс болып саналады, оны-флюоресцентті будандастыру (гибридтеу) (FISH) деп атайды. Бұл әдіс бірнеше сатылардан тұрады:
1) алғаш зерттелінетін хромосомамен не оның бір учаскесімен будандасатын ДНҚ-зонд дайындалады. ДНҚ зонд-биотон не диоксигенин жалғанған ДНҚ-ның бір тізбегі болып табылады.
2) Микроскопиялық препараттағы хромосма ДНҚ-сын сілті ерітіндісімен өңдеп, оны денатурациялайды, яғни ДНҚ жіпшелері арасындағы сутектік байланыстарды үзеді де, ДНҚ жіпшелерін бір-бірінен ажырастырады.
3) Препаратқа ДНҚ-зондты енгізеді. Осы кезде ДНҚ-зонд нуклеотидтері зерттелетін хромосоманың ДНҚ тізбегіндегі нуклеотидтермен комплементарлық байланысады, яғни ДНҚ рунатурацияланады.
4) Осыдан кейін препараттағы биотон не диоксигенинді олармен таңдамалы қосылатын затпен (биотон үшін стрептовидин, дигоксигенин үшін антидигоксигенин) әрекеттестіреді, содан кейін бұл заттарға 1- кезеңмен флюоросцентті бояуларды (қызыл түсті бояу-родамин,жасыл түсті изотиоцианат флюоресцин) қосады.
5) Люминесцентті микроскоп арқылы боялмаған хромосомалар арасынан боялған хромосомаларды айқын көріп, бақылауға, әрі қарай зерттеуге болады.
FISH әдісі арқылы геннің орналасу орнын анықтаудан бастап бірнеше хромосомалық күрделі қайта құрылымдарды ажыратуға мүмкін болады. FISH әдісі анеуплоидияларды анықтау үшін де қолданылады.
№2 дәріс
Тақырыбы: Белоктардың жалпы сипаттамасы
Жоспар: 1. Белоктардың молекулалық массасы
2.Белоктардың биологиялық функциясы
3. Белоктарды бөлу және тазалау әдістері
Жер жүзіндегі тірі ағзалардың негізгі құрамды бөлігі – белок. Ф. Энгельс өзінің «Табиғат диалектикасы» еңбегінде: «Өмір дегеніміз – белокты денелердің тіршілік ету тәсілі» деген.
Демек белок барлық тірінің негізі, ал олардың тіршілік ету тәсілі - өмір болып табылады.
Тірі ағзаның құрамына кіретін белоктар немесе протеиндер (protos – бірінші, алғашқы, маңызды деген грек сөзі) органикалық қосылыстардың 50-85% - ын құрайды.
1871ж. орыс химигі Н.Н. Любавин белоктар амин қышқылдарынан тұратынын анықтады.
Белоктар цитоплазма мен ядроның негізін құрайды. Олар табиғатта кездесетін органикалық заттардың ішіндегі ең күрделісі. Белоктардың элементтік құрамы:
Көміртегі – 50-55%
Оттегі – 21-24%
Азот – 15-18%
Сутегі – 6-7%
Күкірт – 03-2,5%
Кейбір белоктік заттардың құрамына фосфор кіреді, аз мөлшерде кейде темір, мыс, иод, хлор, бром, кальций, мырыш және т.б. элементтер де кездесуі мүмкін.
Белоктардың басқа полимерлерден өзгешелігі – олар құрылысы жағынан бір – біріне ұқсас болғанымен мүлдем басқа мономерлерден құралған.
Белоктың молекулалық салмағы оның құрамындағы аминқышқылдарының санына байланысты. Мысалы, инсулин белогінің құрамында 51 аминқышқылдарының қалдығы бар, екі полипептидтік тізбектен тұрады, молекулалық салмағы 5733, ал гемоглобиннің құрамында 574 аминқышқылдарының қалдығы бар,молекулалық салмағы 64500. Әртүрлі белоктардың құрамындағы аминқышқылдары қалдықтарының саны әртүрлі- 100-ден бірнеше мыңдаған. Белоктың молекулалық массасын әртүрлі физико-химиялық әдістермен анықтауға болады, солардың ішінде кең тарағаны: электрофорез, молекулалық тор әдісі, ультрацентрифугалау т.б.
Нақтылы нәтиже алу үшін бір ғана әдісті емес, әртүрлі әдістерді пайдаланады. Осы әдістерді қолдана отырып белоктың молекулалық салмағы өте кең аралықта ауытқитыны анықталған, 6 мыңнан бірнеше миллион дальтон аралығында.
1. Катализаторлық, ферментативтік қызметі. Ферменттер химиялық құрамы жағынан — белоктар. Олар организмдегі әртүрлі химиялық реакциялардың, процестердің жүру қарқынын реттейді.
2. Тасмалдаушы қызмет атқарады. Айталық қан құрамындағы гемоглобин деген белок оттегін өзіне байланыстырып әртүрлі мүшелердегі ұлпалар мен клеткаларға тасымалдаса, екінші бір қандағы альбумин деген белок май қышқылдарын тасмалдайды.
3.Организмнің қозғалуын қамтамасыз ететін белоктар, оларға бұлшық еттегі актин мен миозин белоктарын жатқызуға болады жөне клетка мембранасындағы тасмалдаушы белоктар т.б.
4.Қорғаныштық қызметі, ондай белоктар организмнің иммундық қасиеттерін жүзеге асырады, қанның ұюы қан сары суының құрамыңдағы фибриноген белогінің фибринге айналуына байланысты. Бұл да белоктың қорғаныштық қасиетін көрсетеді.
5. Көптеген белоктар биологиялық активті заттар. Солардың ішінде гормондар, токсиндер т.б.
6. Белоктардың құрылымдық қызметі. Олар кез-келген клетка протоплазмасының негізі бола отырып, құрылымдық элементтерін қүрайды. Жоғарғы сатыдағы жануарлардағы талшықты коллаген деген белок дәнекер және сүйек үлпаларының қүрамына кіреді, ал α - кератин белогі шаш, тырнақ, жүн, қауырсындардың негізін құрайды. Белоктар жасушадағы липидтермен байланыса отырып жасушалардың, жасуша ішіндегі органоидтардың мембранасын құрайды.
7.Қор ретінде жиналатын белоктар: сүт- казеині, жұмыртқа белогы - альбумин, өсімдік дәніндегі көптеген әртүрлі қор белоктары.
8.Рецепторлық қызметі. Көптеген белоктар, әсіресе гликопротеидтер, таңдамалы түрде белгілі бір заттармен байланысады.
Белоктардың қызметі жоғарыда көрсетілген функцияларымен шектеліп қоймайды. Айталық реттеуші белоктарға ферментгер мен гормондардан басқа да белоктарды жатқызуға болады. Мысалы, гендердің ферменттердің белсенділігін реттейтін белоктар. Сонымен қатар белоктардың халық шаруашылығында да маңызы зор.
Адам тамағының және жануарлардың азығының негізін белоктар құрайды. Жем-шөп құрамындағы белоктың сапасы мен мөлшері ауыл-шаруашылық жануарларының өнімін анықтайды. Көптеген өнеркөсіптердің технологиясы белоктардың қасиеттерін өзгертуге негізделген, атап айтқанда теріні, табиғи жібектерді өндеу. Нан пісіретін өндірістерде ұнның құрамындағы белоктың қасиеті мен сапасы өте маңызды роль атқарады.
Белоктардың құрылымы мен атқаратын қызметін зерттеу үшін биологиялық материалдардан белоктарды бөліп алу қажет. Алдымен биологиялық материалдарды (шикі затты) гомогенді күйге дейін ұсақтайды. Ұсақталған биологиялық материалда белок макромолекуласының жоғары құрылымын ұстап тұрған байланыстар үзіледі, белок молекуласында гидрофобты, гидрофильді топтар саны өзгереді. Бұл белоктың ерігіштігіне әсерін тигізеді. Кейбір белоктар суда ериді, басқа біреулері тұздардың сұйық ерітіндісінде немесе су мен спирт қоспасында ериді. Тіпті ешқандай ерігішті де ерімейтін белоктар да бар.
Ұсақталған белоктарды жасуша құрылымдарынан бөлу үшін гомогенезаторлар, кварц құмымен келіде ұнтақтау (бұл жануарлар жасушалары үшін), ультрадыбыс, шарлы диірмендер (өсімдік жасушалары үшін) қолданылады. Жасуша құрылымдарынан тазартылған белокты диализ әдісін қолданып бос жүрген кіші молекулалардан тазартады. Белоктарды диализдегенде молекулалар мен иондар жартылай өткізгіш мембрана арқылы оңай өтіп, еріткішке көшеді. Ал, коллоидты бөлшектер мөлшері үлкен болғандықтан жартылай өткізгіш мембрана арқылы өтпейді. Еріткішті жиі-жиі ауыстыру арқылы белоктың коллоидты ерітіндісіне бөгде заттардан осылайша тазартады.
Белокты тұнбаға түсіріп шөктіру үшін көбінесе аммоний сульфаты тұзының концентрлі ерітіндісі, сілтілік металдардың және ауыр металдардың тұздары (мыс, сынап, қорғасын, күміс, т.б.) қышқылдар мен гидроксид, спирт ерітнділері (метанол, бутанол т.б.) қолданылады. Алынған белоктар қоспасын жеке дара белоктарға немесе фракцияларға бөледі. Түрлі фракцияға бөлуді хроматографиялық әдіс көмегімен жүргізеді. Хроматографиялық әдістің түрлі модификациялары қолданылады: адсорбциялы, газды, сұйықтықты, гельді, копилярлы, ион алмасу және т.б. сонымен қатар биохимияда ғылыми зерттеулердің мүмкіндігін арттыруға ерекше үлес қосқан рентген құрылымдық анализ, электронды микроскопия, таңбаланған атомдар әдісі, инфрақызыл және ультракүлгін анализ, электрофорез, молекулярлы елек әдісі, масс спектрометрия, ультрацентрифуганы пайдалану, магнитті – оптикалық айналудағы дисперсиялық әдістер, электронды парамагнитті резонанс, ядролық магнитті резонанс және т.б.
Қазіргі кезде бірқатар автоматты биохимиялық анализаторлар, лабораториялар құрылып жұмыс істеуде. Осындай автоматты системалар анализін басқаруда және алынған хабарларды өңдеуде ЭЕМ қолданылады.
Белок молекуласы өте сезімтал, әр түрлі жағдайлардың (қышқылдың, сілтінің, органикалық еріткіштердің, температураның) әсерінен өзінің табиғи қасиетін жоғалтып жоғалтып денатурацияға түседі, сондықтан да белокты бөліп алу төменгі температурада (+40) жүргізіледі. Алынған белок ерітіндісінде жеке белок емес, белоктар қоспасы болады.
Жеке белокты бөліп алу үшін әр түрлі әдістер қолданылады. әдістерді таңдап пайдалану тәжірибелік жолмен алға қойылған мақсатқа сәйкес, ең алдымен бөліп алынатын белоктың физико-химиялық қасиетіне байланысты болады.
№3 дәріс
Тақырыбы: Белоктардың физико-химиялық қасиеттері
Жоспар: 1.Белоктардың химиялық құрылысы
2. Амин қышқылдарының қышқылды-негізді қасиеттері
Белоктың амфотерлік қасиеті, құрамындағы амин қышқылдарының бүйірлік топтарына байланысты. Табиғи белоктардың көшпілігі қышқыл белоктар, олардың құрамында екі карбонды амин қьшқылдары бар, олар негізінен глобула бетінде орналасқан және белок молекуласының физико-химиялық қасиеттерін анықтайды. Зарядтардың молекула үстінде орналасуы бірдей емес, оның әртүрлі аймақтарында бір-біріне қарама-қарсы зарядтар болуы мүмкін. рН- тың өзгеруі радикалдардың диссоциациялану бағытына әсер етеді, молекула үстіндегі зарядтар алмасады, нәтижесінде белоктың кеңістігіндегі құрылымы және оның биологиялық активтілігі өзгереді. Белок молекуласы металл иондарымен, тағы да басқа зарядталған макромолекулалармен әрекеттеседі. Белоктардың катиондармен және аниондармен әрекеттесу қабілетінің үлкен биологиялық мәні бар. Мысалы, белоктардың кальций ионымен байланысуы зат алмасу процестерін реттеуге қатыса отырып көптеген физиологиялық процестерде өте маңызды роль атқарады.
рН-тың белгілі бір деңгейінде белок молекуласының оң заряды мен теріс заряды теңеседі, яғни белок нейтральді, зарядсыз, электр тогы жүйесінде қозғалмайды. рН-тың осы деңгейін сол белоктың изоэлектрикалық нүктесі (ИЭН) дейді. Белок өзінің ИЭН-де тез және толық ертіндіден тұнбаға түседі.
Егер белок құрамында негіздік аминқышқылдары қалдықтары көп болса, онда олардың ИЭН 7-ден жоғары, ал егер қьшқылдық аминқышқыл қалдықтары басым болса ИЭН 7-ден төмен. Көптеген глобулярлы белоктардың ИЭН қышқылдық аралықта (4,5-6,5) болады.
Көптеген белоктар өзінің биологиялық активтілігін, атқаратын қызметін температура мен рН-тың өзіне тән арнаулы деңгейінде ғана сақтай алады. рН-пен температураның экстремалды көрсеткшінде белок молекуласы өзгеріп денатурацияға түседі. Көптеген белоктарда денатурация температураны 50-60°-қа көтергенде байқалады. Жүмыртқа альбуминінің ертіндісін ақырындап 60-70°С-қа дейін қыздырса, алдымен ертінді лайланады, біраз уақыттан кейін ұйып қалады. Осындай құбылыс барлық глобулярлы белоктарды қыздырғанда байқалады. Денатурацияны тек температурамен ғана емес белок ертіндісіне кейбір органикалық ертінділермен (спирт, ацетон) мочевинамен, басқа да детергентермен әсер ете отырып та жасауға болады. Ауыр металл катиондары йод, тиоцианат аниондары ертіндідегі белоктарды денатурацияға түсіреді. Көптеген белоктар өте қышқылдык немесе өте сілтілік ортада ұйып, денатурацияланады. Тіптен механикалық күштердің өзі де, атап айтқанда жоғарғы қысым, құрғақ препараттарды езу, белок ертіндісін қатты шайқау белокты денатурациялайды. Физикалық факторлардың ішінде қыздырудан басқа белок денатурациясына әсер ететін ультракүлгін жарығы, ионизация сәулелері. Денатурация кезінде белоктың көптеген физико-химиялық қасиеттері өзгереді: ерігіштігі төмендейді, тіптен бұл қасиеті жойылады, оптикалық касиеттері, тұтқырлығы (вязкость) т.б. өзгереді. Белок өзіне тән биологиялық активтілігін, атқаратын қызметін жояды. Ферменттер инактивацияланып, каталитиздік қасиетінен айырылып химиялық реакцияны жүргізе алмайды. Денатурация кезінде белоктың кеңістіктегі құрылымы өзгереді (төртінші, үшінші, тіптен екінші деңгейдегі құрылымдар). Тек бірінші деңгейдегі құрылымы, яғни полипептидтік тізбектегі аминқышқыл қалдықтарының реттеліп орналасу тәртібі сақталады. Белоктың толық денатурацияға ұшырауы көптеген жағдайларда қайтымсыз, бірақ белгілі қолайлы жағдайды жасай отырып денатурацияға ұшыраған белокты қайтадан бастапқы

Жылумен өңдеу
Табиғи (нативті) белок Денатуацияланған белок
1-сурет. Табиғи глобулярлы белокты жылумен өңдегенде полипепидтік
тізбек жазылдаы, бірақ коваленттік құрылымы бұзылмайды.
Табиғи қалпына келтіруге балады, мұны денатурация деп атайды. Мысалы денатурацияланған трипсин ферментін жайлап бөлме температурасына дейін суытса ол қайтадан өзінің каталитикалық қасиетіне ие болады.
Белок оптикалық активті зат, өзі арқылы өткен полярланған сәулені не оңға, не солға бұрады. Барлық белоктар ультракүлгін сәулені сіңіреді (190, 250, 280 нм толқын ұзындығында). Бұл қасиеті оның құрамыңдағы ароматты амин қышқылдарына (тирозин, фенилаланин, триптофан), белок молекуласындағы α-спиральдағы сутектік байланыстарға және белоктағы пептидтік байланыстарға тәуелді. Белоктың осы қасиетіне сүйене отырып, оның мөлшерін спектрофотометрлік әдіспен анықтауға болады.
Белок макромолекулалары қарапайым амин қышқылдарынан тұрады. Белоктарды түзетін амин қышқылдарының құрылысын мынадай түрде көрсетуге болады.
R – CH – COOH

NH2
Амин қышқылдары түрлі белок молекулаларын түзетін мономерлі жеке заттар. Адам ағзасында 70 жуық амин қышқылдары бар екені белгілі, бірақ олардың 20 ғана белок молекуласы құрамына кіреді. Бұлар протеиногенді амин қышқылдары.
Кейбір белоктардың құрамында жоғарыда көрсетілген амин қышқылдармен қатар аз мөлшерде минорлы амин қышқылдар болады.
Минорлы амин қышқылдары — радикалдарды түрлендірудің нәтижесінде пайда болған протеиногенді амин қышқылдарының туындылары. Минорлы амин қышқылдарына мысалретінде мына төмендегілерді келтіруге болады.
Аденилилтирозин
Ацетиллизин
Гидроксилизин
Гидроксипролин
Гликозиласпартат
Гликозилсерин
Гликозилтреонин
Гликозилгидроксилизин
Гликозилгидроксипролин
Десмозин и изодесмозин
(лизиннің туындысы),
Карбоксиглутамат
Метиларгинин
Метилгистидин
Метиллизин
Монойодтирозин
Дийодтирозин
Трийодтиронин
Тетрайодтиронин
Сульфотирозин
Фосфосерин
Фосфотреонин
Цистин
 Глициннен басқа амин қышқылдарына оптикалық активтілік тән. Протеиногенді амин қышқылдары тек L- формада ғана болады, бірақ тірі табиғатта D-амин қышқылдардың бар екені байқалады, олар ұзындығы қысқа пептидтер құрамында немесе бос жеке күйде болуы мүмкін.
Глициннен басқа амин қышқылдарына оптикалық активтілік тән. Протеиногенді амин қышқылдары тек L- формада ғана болады, бірақ тірі табиғатта D-амин қышқылдардың бар екені байқалады, олар ұзындығы қысқа пептидтер құрамында немесе бос жеке күйде болуы мүмкін.
Амин қышқылдары молекуласында карбоксильдік (- СООН) топ та, аминдік (- NH2) топ та бар. Амин қышқылдары молекуласында аминдік топ α,- β,- γ- жағдайында және басқа да түрінде болуы мүмкін. Табиғи белоктардан тек α-амин қышқылдары ғана табылған. Олардың биологиялық маңызы зор, себебі олардан белок молекулалары құралады. Амин қышқылдарының құрамында R-радикал бүйірдегі топтарды көрсетеді. Радикал құрамында ашық, жабықта тізбек және әр түрлі фуңкциялық топтар болуы мүмкін.
Амин қышқылдарының жіктелуі
Табиғатта кездесетін барлық амин қышқылдарға жалпы қасиет амфотерлік, яғни әрбір амин қышқылының құрамында кем дегенде бір қышқылдық бір негіздік топтарының болуымен сипатталады.
Жалпы формулада көрсетілгендей амин қышқылдары бір-бірінен R-радикалының химиялық табиғатымен ерекшеленеді. Барлық α -амин және α -карбоксил топтары белок молекуласындағы пептидті тізбек түзуге қатысады. Осы кезде олар өздерінің амин қышқылдарына еркін сәйкес қышқылды-негізді касиетін жоғалтады.
Сондықтан да белок молекулаларының құрылымының түрлі ерекшеліктері және қызметі оның химиялық табиғатына және амин қышқыл радикалдарының физико-химиялық қасиеттеріне байланысты. Осыған байланысты белоктар бірқатар өзіне негізделген ерекшеліктерімен және басқа биополимерлерге тән емес химиялық жекешелігімен ерекшеленеді. Баска принциптер ұсынылғанына қарамай, амин қышқылдарының радикалдарының химиялық құрылыс негізіне байланысты амин қышқылдарын бөледі. Амин қышқылдарын ароматты және алифатгы деп бөледі, сонымен қатар күкірт және гидроксил топтары бар амин қышқылдары деп атайды. Көбіне бөліну амин қышқылының зарядының табиғатына негізделген. Егер радикал нейтрал болса, онда олар нейтрал амин қышқылы деп аталады. Көбіне мұндай қышқылдарда бір амин, бір карбоксил тобы болады. Егер амин қышқылының құрамында амин немесе карбоксил топтары болса, онда олар сол қасиетке сәйкес кышқылды немесе негізді деп аталады. Амин қышқылдарының қазіргі рационалды бөлінуі радикал полярлығына негізделген, яғни олардың сумен әрекеттесу қабілетіне байланысты. Ол амин қышқылының 4 класын, біріктіреді:
1) полярсыз-гидрофобты,
2) полярлы-гидрофильді-зарядталмаған
3) теріс зарядталған,
4) оң зарядталған.
Протеиногенді амин қышқылдарын радикалдарының қалдығына байланысты 4-топқа бөледі.
І. Полярсыз радикалды аминоқышқылдар немесе полярсыз (гидрофобты)
аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH H2N–C–COOH
│ │ │ │
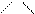 CH3 CH CH2 CH– CH 3
CH3 CH CH2 CH– CH 3
аланин (ала) │ │
CH3 CH3 CH CH2
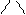 валин (вал) │
валин (вал) │
CH3 CH3 CH3
лейцин (лей) изолейцин (иле)
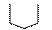 H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH HN–C–COOH
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH HN–C–COOH
│ │ │
CH2 CH2 CH2
 │ │ │ пролин (про)
│ │ │ пролин (про)
 CH2
CH2
│
S–CH3 │
метионин (мет) NH фенилаланин (фен)
триптофан (три)
1. Зарядталмаған полярлы радикалды аминоқышқылдар немесе полярлы
(гидрофильді) зарядталмаған аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH H2N–CН–COOH
│ │ │
CH2OH CH–OH CH2
Глицын (гли) серин (сер) │ │
 CH2
CH2
треонин (тре)
│
ОН
тирозин (тир)
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH
│ │ │
CH2SH CH2 CH2
цистейн (цис) │ │
O=C–NH2 CH2
аспарагин (асп) │
O=C–NH2
глутамин (глу)
2. Теріс зарядталған полярлы радикалды аминоқышқылдар немесе теріс
зарядталған (қышқылды) аминоқышқылдар.
H2N–CH–COOH H2N–CH–COOH
│ │
CH2 CH2
│ │
COOH CH2
аспартат (асп) │
COOH
глутамат (глу)
3. Оң зарядталған полярлы радикалды аминоқышқылдар немесе оң
зарядталған (негізді) аминоқышқылдар.
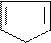
H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH
│ │ │
(CH2)4 (CH2)3 CH2
 │ │ │
│ │ │
NH2 NH =C–NH2
лизин (лиз) аргинин (арг)
NH
гистидин (гис)
Амин қышқылдарының қышқылды-негізді қасиеттері белоктардың көптеген физико-химиялық және биологиялық 4 қасиеттерін анықтайды. Амин қышқылдарын бөлу және идентификациялау осы қасиеттерге негізделген. Амин қышқылдар суда тез ериді. Олар судың нейтрал ерітінділерінде, биполярлы ион (цвиттерион) формасында кристалданады. Барлық амин қышқылдары физиологиялық рН мәнінде цвиттерион құрылымында болады).
R R
׀ ׀
H – C – NH2 H – C – NH3+
׀ ׀
COOH COO¯ цвиттерион
Кристалды аминқышқылын еріткенде, мысалы: аланинді суда еріткенде ол қышқыл тәрізді (протон беруші донор)
NH3 – CH – COO¯ NH2 – CH – COOH
׀ ׀
CH3 CH3
немесе негіз сияқты (протон қосып алушы):
N+H3CH(CH3)COO¯ + H+ N+H3CH(CH3)COOH
Амин қышқылдарының амфотерлік ерекшелігі болғандықтан, олар күшті негіздермен де, күшті қышқылдармен де әрекеттесіп тұз түзеді:
R – CH – COOH + NaOH R – CH – COONa + H2O
׀ ׀
NH2 NH2
R – CH – COOH + HCl R – CH – COOH
׀ ׀
NH2 NH3Cl
рН белгілі мәнінде амин қышқылы молекуласының электрлік заряды нольге тең және ол изоэлектрлік нүктеден не анодка не катодка жылжымайды. рН-тың мұндай мәні изоэлектрлік нүкте деген ат алады және рI-деп белгіленеді.
Амин қышқылдарының изоэлектрлік нүктесі, қосымша қышқылды немесе сілтілік топтармен байланыспайтын, екі рК мәнінің арасындағы қосындының орта санына тең.
Белоктардың амин қышкылдық құрамын зерттеу үшін бірінші қышқылды (НСІ), сілтілі (NaОН) және жиірек ферментативті гидролизді пайдаланады.
Белоктың аминқышқылды құрамы XX гасырдың 30-шы жылдарында ғана анықталды.
1871 жылы Н.И.Любавин (орыс оқымыстысы) өзінің зерттеулерінде ас қорыту сөлі ферментінің әсерінен белоктардың аминқышқылына дейін ыдырайтынын анықтады. Осы жасалған тәжірибелер белок құрамын анықтауда басты роль атқарды. Осыдан кейін А.Данилевский мен Э.Фишер амин қышқылдарының бір-бірімен пептидті байланысып, тізбектесіп тұратынын айтты.
Осы екі зерттеулерден екі маңызды тұжырым жасалған: біріншіден - белок құрамына амин қышқылдары кіреді, ал екіншіден - гидролиз әдісімен белоктардың химиялық және амин қышқылды құрамы зерттеледі.
Таза белокты гидролиздегенде, егер оның ешқандай қоспасы болмаса, онда 20 түрлі α – амин қышқылдары бөлініп шығады. Басқа да көптеген өсімдіктер, микроағзалар, жануарлар ұлпасындағы амин қышқылдары табиғатта еркін түрде және қысқа пептид түрінде немесе басқа да органикалық заттармен қосылыс түрінде кездеседі.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2477; Нарушение авторских прав?; Мы поможем в написании вашей работы!