
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Белоктарды топтастыру. 3 страница
|
|
|
|
Бір а-РНҚ 10-15 ретке дейін трансляциялана алады, себебі 15 рет трансляцияланғанда поли-(А)-фрагмент 150-ге дейін нуклеотидтерінен айырылады (15x10=150) және оның ұзындығы сындарлы ұзындыққа-50 нуклеотидке дейін жетеді.
Поли-(А)-фрагменттің ыдырауы мен транслцңия арасындағы байланысты қалай түсіндіруге болады?
Оның тетігі (механизмі) төмендегідей болуы мүмкін (37-сурет).
Оған сәйкес, поли-(А)-фрагмент өзінің 31 ұшымен а-РНҚ-ның белгілі бір трансляцияланатын учаскесімен әрекеттсеіп ілмек пайда етеді және онымен сутектік байланыс арқылы байланысып қос тізбектік құрылым түзеді. Осындай қос тізбекті күйінде поли-(А)-фрагменттің 31 ұшы 3'-РНҚ-аза ферментінің әсеріне берілмейді.

17-сурет. Поли-(А)-фрагменттің 10-15 нуклеотидтер үзіліп шығарыла-
қысқару және ыдырау жобасы (Мушкамбаров, Кузнецовтан, 2003)
Аталған учаске арқылы рибосома өткен кезде шамалы уақытқа дейін ілмек үзіледі және а-РНҚ-ның 31ұшы РНҚ-аза әсеріне ілігіп бір-бірлеп 10-15 нуклеотидтер үзіліп шығарылады.
Поли-(А)-фрагментте 50 нуклеотид қана қалған кезде а-РНҚ-ның З1 ұшында ілмек пайда бола алмайды және РНҚ-аза ешбір кедергісіз а-РНҚ-ны түгелдей ыдыратады.
№12 дәріс
Тақырыбы: Ақуыз биосинтезі (трансляция)
Жоспар: 1. Генетикалық код және оның қасиеттері
2.Генетикалық кодтың негізгі қасиеттері
3. Ақуыз биосинтезі немесе трансляция тетіктері
Жоғарыда айтқанымыздай тұқым қуалаушылық ақпарат ДНҚ молекуласында генетикалық код күйінде жазылған.
Генетикалық код (кодтау) -дегеніміз тұқым қуалаушылық ақпараттың, яғни 20 аминқышқылдар туралы ақпараттың, ДНҚ молекуласындағы 4 нуклеотидтер (А,Г,Ц,Т) арқылы қысқаша жазылу, сақталу және жүзеге асу жүйесі болып табылады.
ДНҚ молекуласының екі тізбегі бір-бірінен қызметтік ролі жағынан ерекшеленеді: олардың біреуі-кодтаушы немесе мағыналы, ал екіншісі -матрицалық (қалып) тізбектер болып табылады. ДНҚ мағыналы тізбегі: (51) - ТТЦ-АГТ-ЦАГ-ГАЦ-ГАТ-АЦГ- (З1) ДНҚ матрицалық тізбегі: (З1) - ААГ-ТЦА-ГТЦ-ЦТ-ЦТА-ТГЦ- (51)
Транскрипция 4-
а-РНҚ (51)- УУЦ-АГУ-ЦАГ-ГАЦ-ГАУ-АЦГ- (31)
Трансляция 4, Полипеитид тізбегі: (NН2)-Фен -Сер -Глн -Асп -Асп -Тре -(СООН)
ДНҚ молекуласындағы ақпараттың өлшем бірлігі болып триплет саналады, яғни үш нуклеотид бір аминқышқнлын анықтайды. Сонымен генетикалық код (кодон) 1 нуклеотидтен көп болуы тиіс, себебі егер кодон 1 нуклеотидтен тұрады десек, 4 нуклеотид 4-ақ кодонды қалыптастырар еді, ал аминқышқылдар саны 20, демек 4 кодон жеткіліксіз. Ал егер генетикалық код 2 (жұп) иуклеотидтен тұрады десек, 4 нуклеотидтерден 16 әртүрді жұптарды (42=16) жұптастыруға болар еді, бірақ 16 кодон да 20 аминқышқылдары үшін жеткіліксіз.
1954 жылы американ ғалымы Г.Гамов теория күйіңде генетикалық код (кодон) 3 нуклеотидтерден (триплетті) тұруы мүмкін деген болжам айтқан. Шынында да 4 нуклеотидтерден (А,Г,Ц,Т) 64 әртүрлі үштіктерді (43=64) құрастыруға болады және 64 кодон 20 аминқышқылдары үшін әбден жеткілікті. Мүмкін кодон 4 нуклеотидтен тұратын шығар, бұл жағдайда 4 нуклеотидтен (А,Г,Ц,Т) 256 әртүрлі үштіктерді құрастыруға болар еді, бірақ 20 аминқышқылы үшін осыншама көп (256) кодон болады деп болжамдау ақылға қонбайды, себебі табиғат өзінің дамуында үнемі үнемді жолдарды таңдап отырған.
1961 жылы Ф.Крик генетикалық код триплетті (3 нуклеотидтен тұратындығын) болатынын тәжірибе жасап дәлелдеді, яғни лабораториялық жағдайда 3 Урацилдің (УУУ) фенилаланин аминқышқылын анықтайтынын көрсетті. Ал, 1964 ж. М. Ниренберг, Е. Очао, Х.Хорана т.б. еңбектерінің нәтижесінде барлық 64 кодонның мағынасы анықталып, олардың негізгі қасиеттері белгілі болды.
64 кодонның 61- машналы кодондар, яғни 20 аминқышқылының біреуін анықтайды, ал 3-еуі (УАА, УАГ, УГА) мағынасыз кодондар, яғни ешқандай аминқышқылдарын анықтамайды, олар ақуыз синтезінің аяқталуын бақылайды, еондықтан оларды-«стоп кодондар», «кодон-терминаторлар» деп те атайды.
ДНҚ молекуласының кодтарына сәйкес келетін а-РНҚ триплеттерін кодондар деп атайды.
1. Генетикалық код әмбебапты болады, яғни кодондар барлық
тірі ағзаларда бірдей аминқышқылдарын анықтайды;
2. Генетикалық код коллинеарлы (сәйкес) болады, яғни нуклеин
қышқылдарындағы (ДНҚ, РНҚ) нуклеотидтер бірізділігі полипептид
молекуласындағы аминқышқылдар бірізділігіне сәйкес болады;
3. Генетикалық код артық (вырожденный) болады, яғни әрбір
аминқышқылы 2-6 кодон арқылы анықталады, тек метионин және
триптофан аминқышқылдары бір ғана кодон арқылы анықталады.
Бір аминқышқылдарының кодондары бір-бірінен үшінші (соңғы) нуклеотидтері арқылы ерекшеленеді, мысалы: серин кодондары-УЦУ, УЦЦ, УЦА, УЦГ.
Құрылысы жағынан ұқсас аминқышқылдардың кодондары да ұқсас болады, яғни олардың екі нуклеотиді бірдей, мысалы: Аспарагин, Глутамин сияқты ұқсас аминқышқылдардың кодондарының алғашқы нуклеотидтері бірдей (ГАУ, ГАЦ, Г, ГАГ).
4) кодондар а-РНҚ тізбегінде бірінен кейін бірі үзіліссіз -
үтірсіз, нүктесіз, бірізділікпен орналасады;
5) кодондар а-РНҚ тізбегінде бірін-бірі бастырмаламай орналасады;
кодондар нақтылы болады, яғни әрбір мағыналы кодондарға бір аминқышқылы сәйкес келеді;
6) Кодондар триплетті (үш ерімді) болады.

Ала —аланин, Арг — аргинин, Асн — аспарагин, Асп — аспарагин қышқылы; Вал — валин, Гис — гистидин, Гли — глицин, Глн — глутамин, Глн — глутамин кышқылы, Иле — изолейцин, Лей — лейцин, Лиз — лизин, Мет — метионин, Про — пролин, Сер — серин, Тир — тирозин, Тре — треонин, Три —триптофан, Фен — фенилаланин, Цис — цистидин, Стоп — стопкодон.
ДНҚ молекуласындағы тұқым қуалаушылық ақпараттың экспрессиялануының келесі кезеңі — ақуыз биосинтезі немесе трансляция.
Ақуыз биосинтезі жасушаиың тіршілігі үшін ете қажет, себебі жасушаның тіршілік үдерістерінде ақуыз молекуласы түрліше қызметтер атқарып, әртүрлі биохимиялық реакцияларға қатынасып, ыдырап жойылып отырады. Ал олардың орнын толтыру ақуыз молекуласының жаңадан синтезделуі арқасында жүзеге асады.
а — РНҚ молекуласындағы нуклеотидтер бірізділігінде жазылған ақпараттың коллинсарлы полипептид молекуласының аминқышқылдары ретіне берілуін транслясц немесе ақуыз биосинтезі деп атаймыз.
Трансляция немесе ақуыз биосинтезі полипептидтің N ұшынан басталып С ұшына қарай жүреді.
Ақуыз биосинтезіне рибосоманың екі бөлшегі, а-РНҚ, т-РНҚ, 20 аминқышқылдар, аминоацил-т-РНҚ-синтетаза ферменттері және басқа да қосымша ақуыз факторлары қатынасады және олар түрліше қызметтер атқарады.
а-РНҚ ақуыз биосинтезі үшін матрица (қалып) болып табылады, р-РНҚ лар (5S рРНҚ, 5,8 S рРНҚ, 18 S рРНҚ, 28 S рРНҚ) рибосома бөлшектерінің құрамына кіреді, ал рибосомалар болса цитоплазмада ақуыз биосинтезін жүргізуші органеллалар болып табылады. Рибосомалар гиалоплазмада еркін күйінде (полисомалар) кездесуі мүмкін, оларда ішкі ақуыздар синнтезделінеді және мембраналармен байланысқан күйінде кездесуі мүмкін. Бұл жерде «экспорттық», мембраналық және лизосомалық ақуыз молекулалары синтезделінеді. Трансляция немесе ақуыз биосинтезіне еркін аминқышқылдар (жалпы саны 20) қатынаспайды, т-РНҚ-лармен байланысқан аминоацил-т-РНҚ (аа-тРНҚ-Ала-тРНҚ; Мет-т-РНҚмет т.б.) күйінде қатынасады. Әрбір аминқышқылдарына сәйкес келетін, оларды тасымалдайтын т-РНҚ-лар болады.
Гиалоплазмада кездесетін еркін аминқышқылдар (20) өздеріне сәйкес келетін т-РНҚ-ларға қалай болса солай емін-еркін байланыса алмайды. Ол үшін алғаш аминқышқылдарының активтенуі қажет және бұл үдеріс энергия жұмсаудфы қажет етеді. Энергия көзі болып АТФ гидролизі саналады.
Аминқышқылдарының акткивтенуі және активтенген аминқышқылдардың өздеріне сәйкес т-РНҚ молекуласының
акцепторлық ұшына қондырылуын қадағалайтын, басқаратын ерекше ферменттер-аминоацил-т-РНҚ-синтетаза ферменттері болады. Әрбір 20 аминқышқылдарына сәйкес келетін аминоацил-т-РНҚ-синтетаза ферменттері белгілі, демек олардың да соңы - 20. Аминоацил—т-РНҚ-синтетаза ферменттерінде 2 танып білуші орталық болады: бірі-аминқыш-
ылдарға, екіншісі т-РНҚ-ға арналған.

18-сурет. Аминцил-т-РНҚ синтетаза ферментінің белсенді орталықтары
(Мушкамбаров, Кузнецовтан, 2003)
т-РНҚ-ның а-РНҚ кодондарымен әрекеттесуі комплиментарлық және антипаралель принциптеріне сәйкес жүреді, яғни а-РНҚ кодондарының мағынасы 5'→3' бағытында жазылған болса, т-РНҚ-ның антикодондары 3'->5' бағытында оқылады. Бұл кезде кодонның және антикодонның алғашқы 2 нуклеотидтері бір-бірімен тек комплиментарлы байланысады (А-У және Г-Ц), ал үшінші негіздің байланысуы өзгеше болады және ол төмендегі нұсқа бойынша жүзеге асады: Т-РНҚ антикодонының Үшінші нуклеотиді
а) Егер т-РНҚ антикодонының үшінші нуклеотиді Ц не А болса,
онда ол тек бір түрлі кодонмен байланысады (Ц-Г; А-У);
б) Ал, егер т-РНҚ антикодонының үшінші нуклеотиді У не Г
болатын болса, ол 2 түрлі кодондармен байланыса алады
в) Ал егер антикодонның 3-ші нуклеотиді инозин (И) болатын болса, онда ол 3 түрлі кодонмен жұптаса алады И-У,Ц,А;
Әрбір т-РНҚ-лар аминқышқылдарды бірнеше рет тасымалдай алады. Ақуыз синтезі рибосома бөлшектерінің (кіші бөлшегі, үлкен бөлшегі) өзара қосылып, біртұтас органелла пайда етуінен басталады (инициация). Рибосома бөлшектерінің қосылуы белгілі бір тәртіппен жүреді және ол рибосоманың белсенді (актив) орталықтарының қатынасуымен жүзеге асады. Рибосоманың актив (белсенді) орталықтары оның бөлшектерінің (кіші, үлкен) түйісуші беттерінде орналасқан. Біртұтас рибосома пішіні жүрекке ұқсас болады, оның оң жақ бөлігін — кіші бөлшек, сол жақ бөлігін — үлкен бөлшегі құрайды. Екі бөлшектер арасында үлкенді-кішілі қуыстар болады. Осы қуыстарға а-РНҚ, пептидил-т-РНҚ және кезекті аминоацил—т-РНҚ орналасады
(19 сурет).

19-сурет. Рибосомалардың белсенді орталықтары (Мушкамбаров, Кузнецовтан, 2003)
Сонымен рибосомада 4 белсенді (актив) орталықтар кездеседі:
1) а-РНҚ байланысатын орталық (М-орталық), бұл а-РНҚ-ның
5'-трансляцияланбайтын учаскесінің 5-9 нуклеатидіне комплиментарлы
18 S р-РНҚ-ның бір учаскесі болып табылады.
2) Пептидил орталығы (П-орталық). Трансляция басталар алдында
осы орталықпен инициаторлық аминоацил —т-РНҚ, яғни инициаторлық
аминоацил т-РНҚимет байланысады. Кейінірек П-орталықта өсіп
келе жатқан полипептид тізбегіне енді ғана қосылған пептедил-
тРНҚ орналасады.
3) Аминқышқылы орталығы (А-орталық) — бұл орталықпен
кезекті аа-т-РНҚ байланысады.
4) Пептедилтрансферазалық орталық (ПТФ-орталық)-полипептидтің
аминқышқылдары арасында пептидтік байланыстарды пайда етуші
және полипептидті бір аминқышқылына ұзартатын орталық.
Осы 4 орталық рибосома бөлшектерінде түрліше орналасқан: кіші бөлшекте—түгелдей М-орталық, А-орталықтың негізгі бөлігі және П-орталықтың шамалы бөлігі орналасқан; үлкен бөлшекте -П және А орталықтардың қалған бөліктері, яғни П-орталықтың негізгі бөлімі, А-орталықтың шамалы бөлімі және түгелдей ПТФ орталығы орналасқан.
№13 дәріс
Тақырыбы: Трансляция немесе ақуыз биосинтезінің инициациясы
Жоспар: 1. Трансляцияның терминациялануы
2. Трансляция ингибиторлары
Ең алдымен а-РНҚ-ның 5'-трансляцияланбайтын учаскесі рибосоманың кіші бөлшегімен (18 S р-РНҚ,) байланысады. Бұл кезде инициаторлық кодон (АУГ) П-орталық деңгейінде орналасады, әрі қарай инициаторлық кодон мен (АУГ) инициаторлық аа-р-РНҚ (Мет-аа-т РНҚимет) комплиментарлы байланысады. Ал, соңғысы үлкен бөлшектің П-орталығымен әрекеттесіп рибосоманың екі бөлшегінің біртұтас органеллаға жинақталуын қамтамасыз етеді (40 еурет).
Сонымен қатар, трансляция инициациясы үшін ГТФ және 3 инициация факторлары-еІҒ-1, еІҒ-2, еІҒ-3, қажет. Бұлардың ішінде еІҒ-3 рибосоманың еркін кіші белшегіне қосылып, оның үлкен бөлшегімен күні бұрын байланысуын болдырмайды және онымен а-РНҚ-ның байланысуына көмектеседі.
еІҒ-2 факторы инициаторлық аа-т-РНҚ-ның байланысуын қамтамасыз етеді. Бұл кешен ГТФ-пен де байланысқан. Содан кейін Мет-т-РНҚимеІ, өз орнына, П-орталыққа орналасу барысында ГТФ-ГДФ-ға дейін гидролизденеді. Бұл кезде еІҒ-3 және, еІҒ-2 рибосоманы тастап шығып кетеді.
Сонымен, белсенді біртұтас рибосоманың жинақталуы, яғни инициаторлық кешеннің түзелуі, бір макроэнергиялық байланыстың үзілуі арқылы жүреді. (ГТФ →ГДФ). Осы кезде бөлінетін энергия үдерістің қажетті бағытта жүруі үшін термодинамикалық стимул болып табылады.

20-сурет. Ақуыз биосинтезінің жобасы (Айала, Кайгерден 1987)
А-еркін бөлшектер; Б-инициаторлық кешен; В-толық жинақталған рибосома
 еІҒ-1 факторы еІҒ-2-ге кезекті ГТФ пен Мет-т-РНҚямеІ жалғау арқылы оның жаңадан зарядталуына мүмкіндік береді.
еІҒ-1 факторы еІҒ-2-ге кезекті ГТФ пен Мет-т-РНҚямеІ жалғау арқылы оның жаңадан зарядталуына мүмкіндік береді.
Инициациядан кейін трансляцияның негізгі кезеңі — элонгация пептидтік тізбектің ұзаруы) басталады. Ол қайталанып отыратын циклдық сипатқа ие, яғни әрбір кезекті аминқышқылының полипептид тізбегіне қосылуы қайталанып отыратын ұқсас құбылыстардан тұрады.
Элонгация циклдары 3 сатыдан тұрады.
а) аа-т-РНҚбайланысуы. циклдың алғашқы сатысында рибосоманың бос А-орталығы а-РНҚ кодонына комплимен-тарлы антикодоны бар кезекті аа-т-РНҚ-мен байланысады. Жалпы алғанда бұл, иницсиаторлық аа-т-РНҚ-ның П-орталықпен байланысуы сияқты жүреді, яғни ГТФ молекуласы және 2 элонгация факторы (ақуыз) -ЕҒ-1и, ЕҒ-1S пайдаланылады. ЕҒ-1и факторы ГТФ-пен және рибосомаға енген кезекті аа-т РНҚ-мен қосылып кешен пайда етеді. Егер осы аа-т-РНҚ-ның антикодоны А-орталықтағы а-РНҚ-ның кодонына комплиментарлы болмаса, кешен бүл жерде тұрақтамай, диффузия жолымен рибосоманы тастап шығады.
Ал егер, антикодон а-РНҚ кодонымен комплиментарлы болатын болса кешен ыдырап, оның аа-т-РНҚ-сы А-орталықпен байланысады. ГТФ ГДФ-ке дейін гидролизде-неді, ал соңғысы ЕҒ-1и факторымен бірге босанып шығады да, әрі қарай рибосомадан тыс ЕҒ-1 S -пен бірге ГДФ-ның ГТФ-ға айналуына қатынасады және аа-т-РНҚ-ның кезекті молекуласымен байланысады.


21-сурет. Элонгация сатылары (Мушкамбаров, Кузнецовтан 2003)
б) Пептиттік байланыстың түзілуі. Циклдың алғашқы сатысынан кейін рибосоманың П-орталығында пептидил-т-РНҚ, А-орталығында аа-т-РНҚ орналасқан. Олардың акцепторлық ұштары және аминқышқылдар қалдықтары ПТФ-орталықта болады. Соңғысы, яғни ПТФ орталық пептидил-трансферазалық реакцияны қалыптастырады, яңни екі аминқышқылдар арасында пептидтік байланысты қалыптастырады. ПТФ реакциясы нәтижесінде пептидил 1 аминқышқылына ұзарады.
в) Транслокация. Циклдың 3-ші сатысында а-РНҚ жаңадан түзілген пептидил-т-РНҚ-мен бірге бір кодонға солға қарай жылжиды. Осының нәтижесінде П-орталықтағы аминқышқылы рибосомадан шығып кетсе, А-орталықтағы пептидил-т-РНҚ П-орталыққа өтеді, А-орталықта а-РНҚ-ның келесі кодоны болады және кезекті аа-т РНҚ-мен комплиментарлы байланысуға дайын.

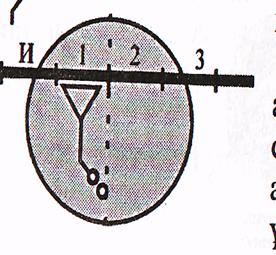
Транслокация сатысына ГТФ және транслоказа деп аталатын элонгация факторы (ЕҒ-2) қатынасады.
Осымен элонгацияның бір циклы аяқталып, келесі циклы басталады. Пептидтік тізбектің бір аминқышқылына ұзаруы үшін 2 ГТФ молекуласының энергиясы жұмсалады.
Трансляцияның аяқталуы туралы сигнал рибосоманың А—орталығына 3 «мағынасыз» кодонның кез-келгенінің —УАА, УАГ не УГА орналасуы болып табылады.
Бұл кодонды аа-т-РНК, емес, терминацияның ақуыздық факторлары (еRҒ) таниды. Мұндай факторлардың екеуі белгілі, олардың бірі-УАА, УАГ-кодон-дарын таныса, екіншісі - УАА және УГА кодондарын таниды. еRК факторлары «өздерінің» кодондарын танып пептидил трансферазалық (ПТФ) орталықтың гидролазалық белсенділігін стимулдайды. Осыған сәйкес т-РНҚ мен пептид арасындағы байланыс гидролизденеді (22-сурет).
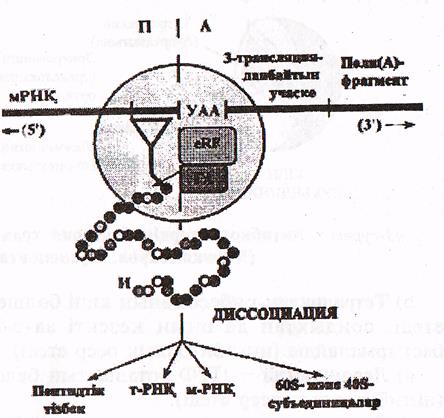
22-сурет. Трансляцияның терминациялануы (Мушкамбаров, Кузнецовтан, 2003)
УУА-терминациялық кодон; еRҒ-терминация факторы; ГА-гидролазалық белсенділік; И-инициаторлық аминқышқылы (метионин)
Осыдан кейін пептидтік тізбек, т-РНҚ және а-РНҚ диссоциацияланып рибосоманы тастап шығады, ал рибосома екі бөлшекке ыдырайды да жаңа полипептидті синтездеуге дайындалады.
Көптеген антибиотиктер қожайын жасушасындағы трансляция процесеіне айтарлықтай әсер етпей микроағзалар трансляциясының арнайы ингибиторлары болып табылады. Олар рибосоманың кіші не үлкен бөлшектеріндегі қызметтік орталықтарға әсер етеді.
а) Стрептомицин- рибосоманың кіші бөлшегіндегі П-орталыққа әсер етеді. Осылайша ол инициаторлық -т-РНҚ-ның (формил мет-т-РНҚимет) П-орталықпен байланысуын қиындатады, яғни ақуыз биосинтезінің иниңиациясына ингибиторлық әсер етеді.
Ақуыз синтезінің инициациясы басталғанымен стрептомицин пептидил-т-РНҚ-ның рибосоманың кіші бөлшегімен байланысуын әлсіздендіреді, бұл рибосомалық кешеннің әлсіз болуына және күні бұрын ыдырап кетуіне алып келеді (23-сурет).

23-сурет. антибиотиктердің бактерия трансляицясына әрекет етуі (Мушкамбаров, Кузнецовтан 2003)
Тетрациклин-рибосоманың кіші бөлшегіндегі А-орталыққа әсер
етеді, сондықтан да оның кезекті аа-т-РНҚ-мен байланысуын
бастырмалайды (ингибиторлық әсер етеді).
в) Левомицетин - ПТФ орталықтың белсенділігін бастырмалайды
(ингибиторлық әсер етеді).
г) Эритромицин —рибосоманың үлкен бөлшегінің транслокацияға
жауапты учаскесіне әсер етіп оны бастырмалайды. Нәтижесінде,
жаңадан түзілген пептидил т-РНҚ П-орталыққа өтпей (ауыепай) А-орталықта қалып қояды. Бұл кезекті аа-т-РНҚ-ның байланысуына кедергі болады.Кейбір антибиотиктер-циклогексимид, пуромицин, интерферондар т.б. заттар эукариоттар трансляцияның ингибиторлары болып ақуыз синтезін шектейді.Мысалы: циклогексимид левомицитин сияқты, ПТФ-орталықты бастырмалайды, бірақ ол бактерияның рибосомасының үлкен бөлшегіне әсер етпей, эукариоттардың рибосомасына (80 S) әсер етеді.
Пуромицин-бактериялар және эукариоттар рибосомасының А-орталығына орналасады да транслокация үдерісін бұзады. Осылайша пуромицин элонгацияны үзіп, қысқа пептидтің синтезделуіне алып келеді..
№14 дәріс
Тақырыбы: Гендердің экспрессиялануының реттелу механизмдері (тетіктері)
Жоспар: 1. Гендердің экспрессиялануының оперондық гипотезасы
2. Лактоза оперонының құрылысы, қызметі
3. Триптофан оперонының құрылысы, қызметтері
ДНҚ молекуласының бойында орналасқан гендердің бәрі бірдей бір мезгілде экспрессияланбайды. Ол, біріншіден - жасуша тіршілігінің белсенділігіне және даму кезеңіне, екіншіден - гендердің экспрессия-лануының реттелу механизмдеріне байланысты болады. Сондықтан да, бір мезгілде әр түрлі жасушаларда түрліше гендер экспрессияланады және ағза дамуының әр түрлі кезеңдерінде бір жасушаның түрліше гендері экспрессияланады.
Сонымен қатар, жасуша гендерін екі топқа бөледі: 1) Жасушаның түпкілікті, әмбебапты тіршілік қызметтерін қамтамасыз ететін және кез-келген жасушалар тіршілігі үшін қажет гендер. Оларды конститутивті немесе «тұрмыстық» гендер деп атайды. Бұл гендер үнемі белсенді күйінде болады және олардың транскрипциялануы реттелуге жатпайды. Бұл гендер кез-келген жасушалардың тіршілігі үшін қажет ақуыздарды (ферменттерді) анықтайды. Бактериялар (ішек таяқшасы) үшін бұл-глюкоза метаболизмінің ферменттері.
Бірақ, әр түрлі конститутивті гендердің транскрипциялану жылдамдығы түрліше болуы мүмкін, оның себептері: 1) промоторлар мен РНҚ полимеразалардың байланысу мүмкіншіліктерінің түрліше болуы. Кейбір промоторлар РНҚ-полимеразамен жеп-жеңіл байланысады, яғни, «күшті болады». Бұл жағдайда РНҚ —полимераза молекуласы промотормен жиі байланысып а-РНҚ-ның көптеген көшірмелері синтезделінеді.
Енді бір промоторлардың РНҚ-полимеразамен байланысу күші төмен болғандықтан, олар сирек байланысып а-РНҚ көшірмелері өте аз мөлшерде синтезделінеді.
2) Екінші себебі РНҚ полимеразаның б-ақуызына байланысты. Бактерия жасушасының тіршілігінің әртүрлі кезеңдерінде әр түрлі промоторларды «танитын» және олармен байланысатын түрліше б — ақуыздар түзіледі. Мысалы, қалыпты жағдайларға, азот тапшылығы кезіне, стресс жағдайына, ыстық жағдайларға, споруляцияға сәйкес келетін б-факторлар. Осындай, әртүрлі жағдайларда, РНҚ-полимераза бір гендердің промоторымен байланысып, басқаларымен байланыспайды.
2) Жасушаның ерекше құрылысын, қызметін қалыптастыратын, барлық гендерде экспрессиялана бермейтін, тек кейбір таңдамалы жасушаларда ғана экспрессияланатын, гендер тобы оларды «молшылық» гендері деп атайды. Осы гендердің экспрессиялануы нәтижесінде әртүрлі жасушаларда әр түрлі ақуыздар синтезделінеді, мыс, эпителий жасушаларында мелонин, бұлшықет жасушаларында миозин, көздің тор қабаты жасушаларында-опсин, родопсин т.б.
Әдетте, бір ген- бір ақуыз (фермент) деген ұғымға (Э.Тейтум, Д.Бидл 1945ж.) сәйкес әрбір ген өз алдына жеке транскрипцияланады деп ойлаймыз. Ал шын мәнінде, бір белгіні дамытуға қажет ақуыздарды анықтайтын бірнеше гендер ДНҚ бойына қатар орналасып, бірге транскрипцияланады. Мұндай гендерді кластерлі гендер деп атайды. Кластерлі гендердің бәрі бірдей транскрипцияланып ортақ полицистронды а-РНҚ түзіледі. Осының негізінде бір белгінің дамуына қажет барлық ақуыздар (фементтер) бір мезгілде синтезделінеді. Кластерлі гендердің экспрессиялануын ерекше реттеуші гендер реттеп отырады.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 3065; Нарушение авторских прав?; Мы поможем в написании вашей работы!