
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рак лёгкого
|
|
|
|
В лёгком возможно развитие разнообразных опухолей, 90–95% из них составляет рак лёгкого, около 5% — карциноиды, 2–5% — опухоли мезенхимального происхождения. Ежегодно в мире выявляют более 1 млн новых случаев рака лёгкого. По заболеваемости и смертности рак лёгкого у мужчин занимает первое место в Европе среди всех опухолей (21% и 29% соответственно). У женщин уровни заболеваемости и смертности от рака лёгкого ниже и составляют 5% и 9%, однако за последние 20 лет эти показатели значительной возросли. Рак лёгкого называют также бронхогенной карциномой, или бронхогенным раком, что подчёркивает возможность развития опухоли из эпителия бронхов и бронхиол.
Бронхогенная карцинома — одна из наиболее фатальных злокачественных опухолей человека. В 75% случаев её диагностируют на поздних стадиях, когда радикальное лечение уже невозможно. Даже после радикального комплексного лечения выживаемость пациентов чрезвычайно низка.
Этиология рака лёгкого в 98% случаев связана с воздействием экзогенных канцерогенов (курение, профессиональные факторы, радиация) и только в единичных случаях — с генетическими причинами. Вероятность развития рака лёгкого возрастает в 30 раз у мужчин и в 90 раз у женщин в возрасте 35–75 лет. Другой важный фактор риска — географические особенности.
Патогенез рака лёгкого — многостадийный процесс, ему предшествуют предраковая дисплазия бронхогенного эпителия и аденоматозная атипическая гиперплазия, часто возникающие на фоне пневмосклероза.
Морфогенез периферического рака лёгкого связан с наличием рубцов. В рубце возможно депонирование экзо- и эндогенных канцерогенов, вызывающих активацию протоонкогенов (ras, fos, bcl-2) и потерю антионкогенов (р53), а также местная гипоксия и иммунодепрессия, разобщение межклеточных взаимодействий, изменение состава коллагенов экстрацеллюлярного матрикса и их соотношения. Всё это нарушает равновесие между процессами пролиферации и дифференцировки эпителия. Поэтому пневмосклероз может играть роль предбластоматозного, фонового процесса в развитии рака.
Патогенез и морфогенез рака лёгкого связаны с нарушением процессов пролиферации, дифференцировки и апоптоза в эпителиальных клетках под действием канцерогенных факторов, появлением очагов гиперплазии, метаплазии и дисплазии бронхиального, бронхиолярного и альвеолярного эпителия. Основной момент патогенеза рака лёгкого — повреждение генома эпителиальной клетки. При этом происходят хромосомные аберрации и мутации генов, большинство из них не строго специфично для рака лёгкого. Для мелкоклеточного рака лёгкого наиболее типична делеция в коротком плече хромосомы 3 небольшой области — 3р14-23.
Стадии морфогенеза рака лёгкого:
стадия предопухоли — гиперплазия и предопухолевая дисплазия;
стадия неинвазивной опухоли (рак in situ);
стадия инвазивного роста опухоли;
стадия метастазирования.
Предопухолевая дисплазия. Характерно развитие изменений в паренхиме и строме. Основные морфологические критерии диспластических процессов в паренхиме органа — появление признаков клеточного атипизма при сохранной структуре ткани. В строме в очагах дисплазии находят изменения состава экстрацеллюлярного матрикса, появление клеточного инфильтрата, фибробластическую реакцию и др. Генетические изменения могут значительно опережать морфологические (ранний диагностический признак предопухолевых изменений).
В крупные бронхи канцерогены попадают с вдыхаемым воздухом, что приводит к повреждению мукоцилиарного барьера и повреждению клеток базального слоя. Затем возможны плоскоклеточная метаплазия, дисплазия и злокачественная трансформация.
В мелкие бронхи, бронхиолы и альвеолы канцерогенные вещества могут попадать не только с вдыхаемым воздухом, но и с кровью и лимфой. Однако, вероятно, концентрации канцерогенов недостаточны для начала процессов малигнизации. Необходимы дополнительные условия, способствующие концентрации канцерогенов. Прежде всего, это хроническое воспаление и пневмосклероз, способствующие нарушению иммунологического контроля за появлением мутированных клеток. Их значение особенно велико при развитии рака лёгкого на фоне туберкулёза, идиопатического фиброзирующего альвеолита, в рубцах после инфаркта лёгкого, вокруг инородных тел («рак в рубце»). В очагах хронического воспаления и пневмосклероза возникают фокусы пролиферации эпителия бронхов, бронхиол и альвеол, состоящие из базальных, реснитчатых, слизистых клеток, клеток Клара, альвеолоцитов II порядка. При прогрессировании процесса возникают метаплазия и дисплазия бронхиального эпителия, очаги аденоматоза с атипией эпителиальных клеток, атипическая гиперплазия эпителия в очагах пневмосклероза.
Классификация рака лёгкого учитывает локализацию опухоли, характер роста, макроскопический вид, стадию процесса, гистогенез.
● По локализации выделяют следующие виды рака:
прикорневой (центральный), исходящий из стволового, долевого и проксимальной части сегментарного бронха;
периферический — из бронхов меньшего калибра, бронхиол и, вероятно, альвеол;
смешанный (массивный).
● По характеру роста:
экзофитный (эндобронхиальный);
эндобронхиальный (перибронхиальный).
● Макроскопические виды рака лёгкого: бляшковидный, полипозный, эндобронхиальный, диффузный, узловатый, разветвлённый, узловато-разветвлённый, полостной, пневмониоподобный.
● По гистогенезу (микроскопически)выделяют следующие виды рака лёгкого:
плоскоклеточный (варианты по гистологическому строению и уровню дифференцировки);
мелкоклеточный [классический (овсяноклеточный, лимфоцитоподобный, промежуточноклеточный) и комбинированный];
аденокарцинома [ацинарная, сосочковая (рис. 11-11), бронхиоло-альвеолярная карцинома, солидная с продукцией слизи];
крупноклеточный рак (гигантоклеточный, светлоклеточный);
железисто-плоскоклеточный рак;
карциноидная опухоль;
рак бронхиальных желёз (аденоидно-кистозный, мукоэпидермоидный и др.).
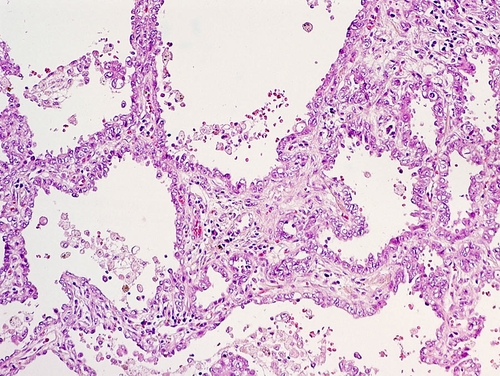
Рис. 11-11. Аденокарцинома лёгкого. Окраска гематоксилином и эозином (x200).
Последняя гистологическая классификация ВОЗ рака лёгкого опубликована в 2004 г. Она основана на гистологических и иммуногистохимических признаках (табл. 11-2), что повышает точность диагностики варианта рака. Без иммуногистохимического исследования диагностическая ошибка может достигать 40%.
Таблица 11-2. Гистологическая классификация рака лёгкого (ВОЗ, 2004 г.)
| Гистологические типы | Варианты |
| Плоскоклеточная карцинома | Сосочковая Светлоклеточная Мелкоклеточная Базалоидная |
| Мелкоклеточная карцинома | Комбинированная карцинома |
| Аденокарцинома | Аденокарцинома, смешанный подтип Ацинарная Папиллярная Бронхиолоальвеолярная карцинома (немуцинозная, муцинозная, смешанная) Солидная аденокарцинома с продукцией муцина |
| Железисто-плоскоклеточная карцинома | |
| Саркоматоидная карцинома | Плеоморфная Веретёноклеточная Гигантоклеточная Карциносаркома Бластома |
| Карциноидные опухоли | Типичная Атипичная |
Крупноклеточный раклёгкого при световой микроскопии содержит крупные раковые клетки. При гистохимическом исследовании и электронной микроскопии они имеют признаки плоского или железистого эпителия.
Мелкоклеточный рак лёгкого — группа опухолей, на светооптическом уровне состоящих из мелких недифференцированных раковых клеток. Однако при гистохимическом исследовании и электронной микроскопии в этой группе обнаруживают опухоли различной дифференцировки: плоскоклеточные, железистые, нейроэндокринные (преобладают), а также неклассифицируемые опухоли.
Нейроэндокринные карциномы бывают следующих видов:
высокодифференцированная (типичный, доброкачественный карциноид);
умеренно дифференцированная (атипичный, злокачественный карциноид);
низкодифференцированная (мелкоклеточный рак с нейроэндокринной дифференцировкой).
Выделяют мелкоклеточный и немелкоклеточный гистологические типы рака лёгкого. Они различны по морфологическим и клиническим проявлениям, реакции на химиотерапию, прогнозу.
Гистогенетические маркёрыразличных типов рака лёгкого.
● Мелкоклеточный рак лёгкого имеет особые биомолекулярные маркёры из группы клеточных онкогенов, генов-супрессоров и факторов роста. Более чем в 90% случаев паренхиматозные клетки экспрессируют маркёры нейроэндокринной дифференцировки (хромогранин, синаптафизин, нейрон-специфическую енолазу и др.), а также эпителиальные маркёры (цитокератины).
● Немелкоклеточный рак лёгкого — гетерогенная группа опухолей из разных гистогенетических групп: плоскоклеточный рак (маркёры — низкомолекулярные цитокератины, кератогиалин), аденокарцинома (высокомолекулярные цитокератины, слизи, сурфактант и др.), крупноклеточный рак (может быть представлен низкодифференцированной аденокарциномой и низкодифференцированным плоскоклеточным раком).
Морфология прикорневого и периферического рака различна.
● Прикорневой рак возникает в крупных бронхах. Предраковые процессы — плоскоклеточная метаплазия и дисплазия бронхиального эпителия, как правило, на фоне хронического воспаления. Преобладающие макроскопические формы — полипозный, узловатый, разветвлённый, узловато-разветвлённый. Гистогенетически прикорневой рак связан с клетками бронхиального эпителия — базальными, бокаловидными и реснитчатыми. Наиболее частые гистологические типы прикорневого рака — плоскоклеточный и мелкоклеточный. Частые осложнения — ретростенотические абсцессы лёгких, ателектазы. Опухоль может прорастать в средостение, перикард, пищевод, сосуды (причина лёгочного кровотечения). Основные методы диагностики — бронхоскопия с биопсией, цитологическое исследование мокроты, рентгенография.
● Периферический рак лёгкого часто развивается на фоне предшествующего хронического воспаления и склеротических изменений — очаговых или диффузных. Предраковые процессы — плоскоклеточная метаплазия, дисплазия эпителия мелких бронхов и бронхиол, аденоматоз с атипией клеток, атипическая гиперплазия эпителия в рубце. Преобладающие макроскопические формы — узловатая, узловато-разветвлённая, полостная и пневмониоподобная. Гистогенез периферического рака связан не только с базальными, бокаловидными и реснитчатыми клетками, но также с клетками Клара и альвеолоцитами II порядка. Это объясняет большее разнообразие гистологических типов периферического рака лёгкого по сравнению с центральным. Так, в периферических отделах лёгкого преобладают железистые карциномы, иногда Бронхиолоальвеолярная карцинома. Плоскоклеточный и мелкоклеточный рак выявляют значительно реже. Основные методы ранней диагностики периферического рака лёгкого — рентгенография и трансторакальная чрезкожная биопсия лёгкого. Осложнения опухоли связаны с её прорастанием в плевральную полость с развитием серозно-геморрагического или геморрагического плеврита, распространением на крупные бронхи, распадом и нагноением самой опухоли.
Метастазирование рака лёгкого на начальных стадиях преимущественно лимфогенное. Первые метастазы обнаруживают в регионарных лимфатических узлах. На поздних стадиях лимфогенные метастазы находят в бифуркационных, паратрахеальных, медиастенальных и шейных лимфатических узлах. Возможен канцероматоз лёгких, плевры и брюшины, гематогенные метастазы в печень, кости, надпочечники, головной мозг.
Молекулярная патология рака лёгкого изучает морфологические и молекулярно-генетические особенности опухоли. Наиболее важно определение биомолекулярных и гистогенетических маркёров рака, а также исследование патологии апоптоза.
Биомолекулярные маркёры рака лёгкого разнообразны и представлены различными генами, белками, гормонами и другими молекулами. В патогенезе рака лёгкого наибольшее значение имеют клеточные онкогены четырёх семейств: myc, ras, bcl, erb-B.
● Семейство myc клеточных онкогенов (c-myc, L-myc, N-myc) — немедленно реагирующие гены. Они кодируют клеточные регуляторные белки, вызывающие пролиферацию и подавляющие дифференцировку. При отсутствии факторов роста повышение экспрессии c - myc вызывает не деление клеток, а апоптоз, ингибируемый bcl -2. Амплификацию с-myc обнаруживают в 10–25% случаев рака лёгкого, в то время как L - myc и N - myc — только в нейроэндокринных опухолях лёгких (10–30%). Экспрессию L - myc обнаруживали только в группе нейроэндокринных опухолей лёгких, а экспрессию с - myc — при мелкоклеточном и немелкоклеточном раке лёгкого. В группе мелкоклеточного рака лёгкого установлена достоверная корреляция экспрессии L - myc и c - myc с наличием метастазов и размерами опухоли.
● Семейство ras клеточных онкогенов подвержено изменениям при опухолевом росте. Гены кодируют синтез белка р 21, влияющего на передачу ростового сигнала в клетке. Описаны мутации, активирующие ras гены с локализацией в 12, 13 и 61-м кодонах. Наиболее часто при раке лёгкого обнаруживают мутации K - ras, присущие только немелкоклеточному раку. Частота мутаций K - ras в аденокарциномах лёгкого составляет до 30%, а в плоскоклеточном раке лёгкого — только 3%. В двух больших исследованиях 30% случаев аденокарцином имели мутации в кодоне 12 и только 3% — в других кодонах. Показана связь K - ras мутаций с табакокурением. K - ras мутации обнаружены при предраке лёгкого — атипической гиперплазии альвеолярного эпителия в 40% случаев в лёгочной ткани вокруг аденокарцином.
● Семейство bcl -2состоит из bcl -2, bax, bak, bclXL, bclXS, их белковые продукты способны образовывать гомо- и гетеродимеры, оказывающие иногда противоположное действие на пролиферацию и апоптоз опухолевых клеток. Наиболее изученный из данного семейства bcl -2 расположен на внутренней мембране митохондрий, а также в ядре. Он стимулирует пролиферацию клеток и ингибирует апоптоз, вероятно, за счёт антиоксидантной активности. Транскрипцию и синтез белков генов bax регулирует р53. Эти гены блокируют пролиферацию и стимулируют апоптоз опухолевых клеток. BclXL ингибирует апоптоз и стимулирует пролиферацию, а bclXS, напротив, индуцирует апоптоз. Таким образом, баланс между белковыми продуктами bcl -2(bax, bclXL, bclXS) определяет сдвиг равновесия в сторону пролиферации или апоптоза в опухоли. Важна ядерная локализация онкопротеина, так как она может соответствовать его неактивной, фосфорилированной форме, не способной блокировать апоптоз.
Онкоген Her 2 neu — независимый фактор прогноза. Его экспрессия свидетельствует о высокой степени злокачественности немелкоклеточного рака лёгкого.
Гены - супрессоры при раке лёгкого блокируют апоптоз и уменьшают тормозящее влияние на клеточные онкогены, что ведёт к активации пролиферации. Для реализации эффекта от повреждений генов-супрессоров изменения должны затрагивать оба аллеля гена, так как мутированный ген-супрессор всегда рецессивен по отношению к сохранному. Например, мутация или делеция одного аллеля гена-супрессора должна происходить с изменениями в другом аллеле. Гены-супрессоры рака лёгкого изучены относительно хорошо.
● Наиболее частые делеции хромосом затрагивают следующие участки: 3p21-24, 17p13, 13q14, 9p21-22 и 5q21. Делеция 3p21-24 наиболее часта (в 100% случаев при мелкоклеточном раке лёгкого, в 85% — при немелкоклеточном раке). Однако в этой зоне нет ни одного гена-супрессора. Другие участки соответствуют известным генам-супрессорам. Так, р53 расположен в 17р13, ген ретинобластомы — 13q14, р16 INK4B (MTS1) и р15 INK4B (MTS2) — 9р21–22, МСС (мутированный ген при раке толстой кишки) и АРС (ген аденоматозных полипов толстой кишки) — 5q21. Функции большинства перечисленных генов хорошо известны и связаны с контролем фазы G1 митотического цикла и/или апоптоза. Их инактивация вызывает ускользание из остановки в фазе G1 и развитие апоптоза. Потеря гетерозиготности была изучена в очагах метаплазии и дисплазии рака in situ. При плоскоклеточной метаплазии выявлена потеря гетерозиготности в сайтах 17р13, 5q21 и 9p21. При этом в разных очагах в пределах одного лёгкого обнаруживают разные мутации. Выявление повреждений генома в области локализации генов-супрессоров на стадии предраковых изменений свидетельствует об участии этих генов в данных стадиях опухолевого роста. Сейчас описан ряд новых генов-супрессоров, вероятно, имеющих значение для развития рака лёгкого и локализованных в хромосомах 1 и 16.
● Ген р53 наиболее изменчив при опухолевом росте. Природный тип р53 — фактор транскрипции с множеством функций (регулировка перехода клеток из G1 в S-фазу, репарации ДНК и апоптоза после повреждения генома). Делеция одного из аллелей (17р13) в сочетании с точковой мутацией в другом аллеле — генетические перестройки, наблюдаемые в большинстве злокачественных опухолей. Мутированный р53 действует как клеточный онкоген, стимулирует пролиферацию опухолевых клеток и вызывает образование антител, выявляемых у пациентов. Последнее стало основанием для разработки иммунодиагностики и иммунотерапии рака лёгкого.
● Мутация вызывает конформационные изменения в протеине р53 и его накопление в ядрах клеток, что позволяет определять его иммуногистохимическими методами. Напротив, природный тип р53 обладает оченькоротким полупериодом жизни (20 мин), поэтому его невозможно определить иммуногистохимически. Накопление мутантного р53 обнаруживают в 70–100% культуры клеток мелкоклеточного рака, 50–70% мелкоклеточного рака операционного и секционного материала и 45–75% немелкоклеточного рака лёгкого. Накопление р53 в ядрах клеток может свидетельствовать о мутации в гене (при выявлении не менее чем двумя методами как минимум 20% позитивных клеток). Р53 негативные наблюдения — не только природный тип р53, но и отсутствие синтеза какого-либо белка р53. Сплайсинговые мутации, не выявляемые иммуногистохимически, составляют примерно 20% р53-негативных случаев. Инактивацию р53 при раке лёгкого обнаруживают примерно в 70% случаев. Исследования корреляции экспрессии р53 с выживаемостью противоречивы. Если такая связь есть, то она несущественна. Непонятна и связь р53 со злокачественной трансформацией. В то же время, эксперименты показывают, что при активации природного типа р53 происходит замедление роста и апоптоз, что может привести к реверсии злокачественного фенотипа.
● Доказано значение мутации р53 на ранних стадиях канцерогенеза лёгкого. Мутантные формы никогда не выявляют при резервной базальноклеточной гиперплазии или плоскоклеточной метаплазии без признаков дисплазии. При дисплазии р53 мутации выявляют в 12–53% случаев, а при раке in situ — в 60–90% случаев. Ожидаемая частота экспрессии р53 при дисплазиях эпителия лёгкого составляет до 91%. Связь накопления р53 при предраке с последующим развитием опухоли достоверна. Обнаружение р53 более чем в 20% клеток в очагах дисплазии — маркёр необратимых предраковых изменений. Однако примерно в 50% случаев рак лёгкого развивается без р53 мутации. Поэтому отсутствие р53 не считают благоприятным прогностическим признаком. Кроме того, накопление р53 и его мутации — не единственные молекулярные механизмы инактивации р53 в опухолях. Белки р53 выявлены в ядрах раковых клеток в 47% наблюдений. При этом частота экспрессии р53 в мелкоклеточном раке лёгкого — 67%, а в немелкоклеточном — 46%. Достоверна корреляция между уровнем экспрессии р53 и стадией заболевания. Доказано, что нарушение работы р53 происходит при его взаимодействии с другими белками-регуляторами митотического цикла — р21, Мdm2, bax.
● Ген Rb расположен в участке 13q14, в нём происходит делеция в 80% мелкоклеточного рака лёгкого (также часто, как при ретинобластоме). Ген кодирует ядерный фосфопротеин массой 110 Кда и контролирует выход клетки из G1 фазы. Гипофосфорилирование Rb приводит к блокаде клетки на стадии G1 и апоптозу. Инактивация Rb в опухолях бывает при потере одного из аллелей и мутации второго аллеля гена. Экспрессия Rb отсутствует в 90% случаев мелкоклеточного рака лёгкого, что имеет плохое прогностическое значение. В немелкоклеточном раке лёгкого экспрессия отсутствует в 30% случаев и прогностически незначима.
● Таким образом, инактивация генов-супрессоров р53 и Rb более значима для развития и прогрессирования мелкоклеточного рака лёгких, чем немелкоклеточного, что подтверждает разные пути онкогенеза этих опухолей.
Факторы роста играют важную роль в развитии рака лёгкого, обеспечивая с помощью аутокринной и паракринной стимуляции рост опухоли. Экспрессию EGFR обнаруживают в плоскоклеточном раке лёгкого, реже в других гистологических типах опухоли. Установлены особенности локализации IGFPB3 — не только в цитоплазме, но и в ядрах раковых клеток.
Адгезивные молекулы,интегриновые рецепторы и экстрацеллюлярный матрикс стромы рака лёгкого оказывают модулирующее действие на опухолевые клетки и обеспечивают рост, инвазию и метастазирование опухоли.
● Первая фаза инвазии опухоли. Характерно ослабление контактов между клетками, снижение концентрации адгезивных молекул из семейства CD44, усиление экспрессии генов, обеспечивающих мобильность опухолевых клеток и их контакт с экстрацеллюлярным матриксом. На клеточной поверхности снижена концентрация ионов кальция, что повышает отрицательный заряд опухолевых клеток. Усилена экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам экстрацеллюлярного матрикса — ламинину, фибронектину, коллагенам.
● Вторая фаза инвазии. Опухолевая клетка выделяет протеолитические ферменты и их активаторы. Они обеспечивают деградацию экстрацеллюлярного матрикса, освобождая путь для инвазии. Продукты деградации фибронектина и ламинина — хемоаттрактанты для опухолевых клеток.
● Третья фаза инвазии — миграция опухолевых клеток в зону деградации экстрацеллюлярного матрикса. Затем происходит повторение процесса.
Патология апоптоза при раке лёгкого бывает следующих видов.
● Чрезмерный апоптоз, приводящий к чрезмерной клеточной гибели или атрофии.
● Недостаточный апоптоз по отношению к уровню пролиферативных процессов (при гиперпластических процессах и опухолевом росте).
● Незавершённый апоптоз с последующим аутолизом апоптозных телец. Это приводит к выходу клеточных онкогенов, факторов роста, цитокинов. Незавершённый апоптоз — мощный источник митогенетических факторов, стимулирующих пролиферацию живых опухолевых клеток. Предполагают, что незавершённый апоптоз при раке лёгкого с последующим аутолизом апоптозных телец может в ещё большей степени стимулировать рост опухоли.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 3475; Нарушение авторских прав?; Мы поможем в написании вашей работы!