
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1. рК 1, 2, 3. 4, 5, 6-го комплексов [Со (NН3)6]3+ равен 35,21
|
|
|
|
рК 1, 2, 3. 4, 5, 6-го комплексов [Со (NН3)6]3+ равен 35,21. Найти константу нестойкости.
Решение.
1. рK - отрицательный десятичный логарифм константы нестойкости. Следовательно, р K = —lg Kнест. Отсюда lg Kнест = —рК. В данном примере lg Kнecт = -35,21. Преобразуем отрицательный логарифм и получаем: lg Кнест = 36,79; откуда Kнест = 6,16 · 10-36
Так как величина константы нестойкости очень мала, то комплекс [Со (NН3)6]3+ является весьма устойчивым.
Величина, обратная константе нестойкости, называется общей или суммарной константой устойчивости. Следовательно,
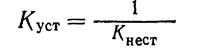
Последняя также характеризует устойчивость комплексных ионов.
Кроме равновесий процессов диссоциации, для комплексных ионов характерно наличие в растворе сольватационных равновесий, вызываемых обменными реакциями комплексных ионов с молекулами растворителя. Так, по данным А. А. Гринберга, комплексные ионы платины [PtCl4]2-, [PtNH3Cl3]- [Pt(NH3)3Cl3]+ и др., вступая в реакцию обмена с водой, образуют аквакомплексы:
[PtCl4]2- + H2O ↔ [PtCl3OH2]- + Cl-
[PtNH3Cl3]- + H2O ↔ [PtNH3Cl3OH2] + Cl-
[Pt(NH3)3Cl3]+ + H2O ↔ [Pt(NH3)3OH2]2+ + Cl-
Образовавшиеся аквакомплексы представляют собой слабые кислоты, способные взаимодействовать с гидроксидами с образованием гидроксокомплексов:
[PtCl3OH2]- + OH- ↔ [PtCl3OH2]2- + H2O
Кроме этого, аквакомплексы способны вступать во взаимодействие с водой с образованием гидроксокомплексных ионов и ионов гидроксония, что приводит к установлению равновесия кислотно-основного типа:

Подобно ступенчатой ионизации электролитов, первые ступени сольватационного равновесия и отвечающего ему кислотно-основного равновесия выражены более резко, чем последующие. В противоположность ионным и кислотно-основным равновесиям, устанавливающимся практически моментально, сольватационное равновесие устанавливается более медленно. Но поскольку сольватационные процессы протекают в ограниченных размерах и еще далеко не изучены, то ими обычно пренебрегают и рассматривают лишь равновесия, обусловленные процессами ионизации комплексов, и в первую очередь процессами вторичной электролитической ионизации, характеризующейся константой нестойкости комплексов
.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 721; Нарушение авторских прав?; Мы поможем в написании вашей работы!