
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартные электродные и окислительно-восстановительные потенциалы
|
|
|
|
Возникновение электрического тока в гальваническом элементе объясняет теория гальванических элементов.
Известно, что при погружении металла в воду или в раствор, содержащий одноименные ионы, с поверхности металла ион-атомы будут до некоторой степени переходить в раствор, а вода, гидратируя катионы, будет удерживать их в растворе. В свою очередь катионы, находящиеся в растворе, быстро двигаясь, будут сталкиваться с поверхностью металла и удерживаться на ней теми же силами, какими они удерживаются в самом металле.
Способность катионов переходить в раствор будет тем больше, чем меньше прочность, т. е. чем меньше энергия ионной решетки металла и чем больше энергия гидратации катиона, т. е. энергия взаимодействия катиона с дипольными молекулами воды.
При переходе ионов из металла в раствор металлическая пластинка заряжается отрицательно, так как на ней остаются избыточные электроны. Вследствие этого возникает электростатическое притяжение между катионами, перешедшими в раствор, и пластинкой. Катионы задерживаются в слое раствора, примыкающем к поверхности металла, на границе соприкосновения металла с раствором образуется двойной электрический слой, который будет препятствовать дальнейшему растворению металла
С другой стороны, при выделении катиона на металле, последний заряжается положительно и притягивает анионы, находящиеся в растворе. В результате этого на границе соприкосновения металла с раствором также образуется двойной электрический слой.
Величина и знак заряда металла, погруженного в раствор своей соли, зависит от того, какая из энергий — энергия гидратации или энергия кристаллической решетки — больше. Если энергия гидратации больше, чем энергия кристаллической решетки, то в первый момент количество катионов, переходящих из металла в раствор, будет больше количества осаждающихся ионов. Металл заряжается отрицательно.
В случае, если энергия кристаллической решетки больше энергии гидратации, поверхность металла приобретает положительный заряд вследствие выделения на ней катионов.
Таким образом, металл, погруженный в раствор его соли, всегда приобретает некоторый потенциал по отношению к раствору. Поэтому металл, опущенный в раствор своей соли, можно рассматривать как электрод, обладающий отрицательным или положительным потенциалом.
Величина и знак потенциала зависят от свойства металла, от его энергии кристаллической решетки; например, потенциал цинка значительно более отрицателен, чем потенциал никеля, кобальта, меди и т. д.
С другой стороны, величина и знак потенциала металла зависят в значительной степени от концентрации одноименных ионов в растворе. Чем больше концентрация их, тем чаще сталкиваются ионы с поверхностью металла и удерживаются на его поверхности силами кристаллической решетки, тем более положительным будет потенциал металла.
Уравнение зависимости потенциала металла от концентрации одноименных ионов в растворе было выведено в 1889 г. В. Нернстом.
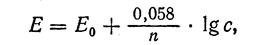
где Е — электродный потенциал металла, Е0 — нормальный или стандартный потенциал этого металла, погруженного в 1 н. раствор его соли, 0,058 — коэффициент, соответствующий температуре 20°С,
n - число электронов, отдаваемых или принимаемых металлом.
Обнаружить и измерить потенциал на электроде непосредственно нельзя. Поэтому в физической химии условно принимают потенциал стандартного водородного электрода равным нулю и с ним сравнивают потенциалы остальных электродов, изготовленных из разных металлов. Потенциал металла, опущенного в 1 н. раствор его соли, называется стандартным потенциалом.
Металлы, расположенные по алгебраически нарастающим значениям нормальных потенциалов, образуют так называемый электрохимический ряд напряжений. Следовательно, электрохимический ряд напряжений металлов есть нечто иное, как ряд нормальных электродных потенциалов, определенных по отношению к потенциалу стандартного водородного электрода.
Рассмотрим потенциалы окислительно-восстановительных пар, состоящих из окисленной и восстановленной формы иона, например:
Fe3+ | Fe2+, Sn+4 | Sn2+ | Cr+6| Cr3+, МnО4- | Мn2+ и т. д.
 Для этого построим гальванический элемент (рис. 6.1), в котором стандартный водородный электрод соединен с электродом из исследуемой окислительно-восстановительной пары. В химический стакан помещают смесь равных объемов растворов хлорида железа (III)FеС13, хлорида железа (II)FeCl2 одинаковых молярных концентраций и 'погружают в нее платиновый электрод. Затем стандартный водородный электрод соединяют проводником с электродом окислительно-восстановительной пары. Включают в цепь милливольтметр для измерения э. д. с. элемента.
Для этого построим гальванический элемент (рис. 6.1), в котором стандартный водородный электрод соединен с электродом из исследуемой окислительно-восстановительной пары. В химический стакан помещают смесь равных объемов растворов хлорида железа (III)FеС13, хлорида железа (II)FeCl2 одинаковых молярных концентраций и 'погружают в нее платиновый электрод. Затем стандартный водородный электрод соединяют проводником с электродом окислительно-восстановительной пары. Включают в цепь милливольтметр для измерения э. д. с. элемента.
Рис. 6.1 Прибор для измерения
электродных потенциалов
Полуэлементы соединяют между собой перевернутой U-образной трубкой, заполненной раствором электролита (КС1). По этой трубке, называемой электролитическим ключом, ионы диффундируют из одного полуэлемента в другой, при этом замыкается внутренняя цепь элемента. Такой элемент работает следующим образом. На аноде происходит процесс отдачи электронов молекулами водорода платине, т. е. происходит реакция окисления водорода:
Н2 — 2е = 2H+ (анодный процесс).
Освобождающиеся при этом электроны перетекают по проводнику к катоду, где их присоединяют ионы Fe3+, восстанавливающиеся при этом в ионы двухвалентного железа:
Fe3+ + е = Fe2+ (катодный процесс).
Общее уравнение реакции, происходящей при работе данного элемента:
2Fe3+ + Н2 = 2Fe2+ + 2Н+
Электродвижущая сила (э. д. с.) этого элемента оказывается равной 0,77 В. Поскольку же она представляет собой разность нормальных окислительных потенциалов обеих пар, можно написать:
Э.Д.С. = E0 Fe 3+ /Fe 2+ - E0 2H+ /H2 = 0,77 В
Но величина E0 2H+ /H2, условно принята за нуль. Следовательно,
E0 Fe 3+ /Fe 2+ = + 0,77 В
Если при работе гальванического элемента окислительно-восстановительная пара отдает электроны ионам водорода, восстанавливая их в H2, то потенциал ее считается отрицательным. Например, в паре Ti+4/Ti3+, соединенной со стандартным водородным электродом, происходит реакция окисления ионов Ti3+ и восстановление ионов водорода:
2Ti3+ - 2e = 2Ti4+
2H+ + 2e = H2
При работе этого гальванического элемента милливольтметр показывает величину э. д. с., равную 0,04 В. Следовательно,
E0 Ti+4/ Ti3+ = - 0,04 В
Если скомбинировать стандартный водородный электрод с парой С12/2С1-, то получится элемент, работу которого можно схематично изобразить так:
H2 - 2е = 2Н+ (анодный процесс)
С12+ 2е = 2C1- (катодный процесс)
Н2 + Cl2 = 2Н+ + 2Сl-
Величина нормального окислительного потенциала пары С12/2С1-оказывается значительно большей, чем у пары Fe3+/Fе2+, а именно она равна E0 Сl2/2Cl- = + 1,36 В. Из этого следует, что способность к присоединению электронов (т. е. окислительная активность) у свободного хлора значительно больше, чем у ионов железа Fe3+. Хлор является более сильным окислителем, чем железо.
Если взять пару MnO4-/Mn2+ в кислой среде и соединить электрод этой пары со стандартным водородным электродом, то э. д. с. полученного гальванического элемента будет равна +1,51В. Следовательно, окислительно-восстановительная пара MnO4-/Mn2+ в кислой среде является еще более сильным окислителем, чем хлор.
Потенциалы окислительно-восстановительных пар, таких, как Fe3+/Fе2+, С12/2С1-, MnO4-/Mn2+ и т. д., в которых химическая реакция связана с переходом электронов от одного иона к другому где электродом служит платиновая пластинка, не принимающая никакого участия в химическом процессе, называются окислительно-восстановительными потенциалами.
Наиболее сильные восстановители - щелочные и щелочноземельные металлы, а также алюминий, цинк и др. Из анионов сильные восстановители - анионы серы, тиосульфат-анион, сульфит-анион и др.
Самым сильным окислителем является газообразный фтор. Ионы фтора не обладают восстановительными свойствами, так как нет такого окислителя, который мог бы отнять у них электроны. Отнятие электронов у ионов фтора может быть осуществлено только путем электролиза из расплавов его солей.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 1603; Нарушение авторских прав?; Мы поможем в написании вашей работы!