
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа и степень гидролиза
|
|
|
|
Количественно гидролиз характеризуется константой гидролиза и степенью гидролиза. Константой гидролиза называется отношение произведения концентраций продуктов гидролиза к концентрации негидролизованных ионов соли. Константа гидролиза определяет состояние динамического равновесия, устанавливающегося в растворе данной гидролизующейся соли.
Степень гидролиза выражает собой отношение концентрации гидролизованной части соли (моль/л) к общей ее концентрации в данном растворе:
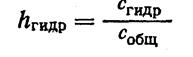
Вычисление константы гидролиза и степени гидролиза слабой кислоты и сильного основания:
1. Чтобы вывести уравнение константы гидролиза, необходимо прежде всего написать ионное уравнение реакции гидролиза:
СН3СООNа + НОН ↔ СН3СООН + NaOH
СН3СОО- + НОН ↔ СН3СООН + ОН-
В общем виде: Аn- + НОН ↔ HAn + ОН-
2. Применив к обратимому процессу гидролиза закон действия масс, можно написать уравнение константы химического равновесия:
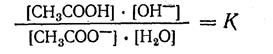
Так как вода в разбавленных растворах находится в избытке, то концентрация ее практически не изменяется при любом смещении равновесия гидролиза. Поэтому величину [Н2O] можно считать постоянной и перенести в правую часть уравнения:
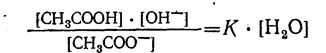
Произведение двух постоянных величин К и Н2O представляет собой также величину постоянную, обозначим ее через Kгидр и получим уравнение константы гидролиза:
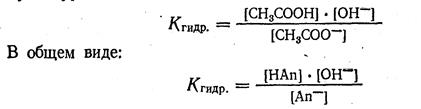
3. Численное значение Kгидр можно найти из величины ионного произведения воды Kн2о и константы ионизации получающейся слабой кислоты, в данном случае Kсн3соон. Действительно, из уравнения ионного произведения воды [H+] · [OH-] = Кн2о следует, что:
[ОН-] = К Н2О / [Н+]. Подставив выражение для [ОН-] в уравнение константы гидролиза, находим:
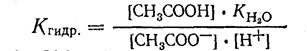
Отношение 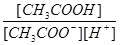 представляет собой величину, обратную константе ионизации уксусной кислоты. Подставляя это значение в уравнение константы гидролиза, получим:
представляет собой величину, обратную константе ионизации уксусной кислоты. Подставляя это значение в уравнение константы гидролиза, получим:

Пользуясь выведенным уравнением, находим величину константы гидролиза. Для взятой нами соли CH3COONa

Следовательно, константа гидролиза бинарной соли, образованной сильным основанием и слабой кислотой, численно равна ионному произведению воды, деленному на величину константы диссоциации слабой кислоты, получающейся в процессе гидролиза соли.
Для вычисления степени гидролиза примем, что концентрация соли в растворе равна с (моль/л) и что степень гидролиза равна h. Тогда концентрация гидролизованной части соли, равная концентрации ионов, будет c·h.
Концентрация негидролизованной части соли будет с — ch или
с (1—h). Подставив принятые обозначения в уравнение константы гидролиза, получим:
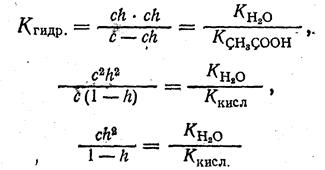
Так как величина h обычно мала по сравнению с единицей, то ею можно пренебречь и принять, что

По этому уравнению найдем величину степени гидролиза 0,1 М раствора ацетата натрия CH3COONa:

Степень гидролиза бинарных солей, образованных катионами сильных оснований и анионами слабых кислот, равна корню квадратному из отношения ионного произведения воды к произведению константы ионизации кислоты на концентрацию соли в растворе. Для двух сравниваемых солей указанного типа при постоянной температуре степень гидролиза будет тем больше, чем меньше константа ионизации кислоты, получающейся при гидролизе, т. е. чем слабее кислота, чем меньше концентрация соли и чем выше температура, так как с повышением температуры увеличивается ионное произведение воды.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 2090; Нарушение авторских прав?; Мы поможем в написании вашей работы!