
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние одноименных и других ионов на растворимость электролитов. Солевой эффект
|
|
|
|
Если к насыщенному раствору электролита прилить раствор другого электролита, содержащего общий, или одноименный, ион, то произведение концентраций ионов превысит величину произведения растворимости, раствор станет пересыщенным, а пересыщенные растворы при стоянии выделяют часть растворенного вещества в виде осадка. Например, если к насыщенному раствору сульфата кальция CaSO4 будем приливать понемногу концентрированный раствор серной кислоты, все время перемешивая содержимое цилиндра палочкой, то через некоторое время выпадает белый кристаллический осадок сульфата кальция CaSO4. Таким образом, в полном согласии с правилом произведения растворимости растворимость сульфата кальция CaSO4 в присутствии серной кислоты оказывается меньшей, чем в чистой воде. То же самое происходит и в других случаях, т. е. растворимость электролитов понижается при введении в их раствор каких-либо сильных электролитов с одноименным ионом.
Сделаем количественный расчет влияния одноименного иона на растворимость малорастворимого электролита.
Пример 1. Вычислить растворимость хлорида серебра AgCl в чистой воде и в 0,01 н. растворе хлорида калия КС1 без учета и с учетом коэффициентов активности.
Решение.
1. Вычислим молярную растворимость хлорида серебра AgCl в воде. Произведение растворимости: ПРAgcl = 1,78·10-10. Примем молярную растворимость AgCl равной х. Растворение AgCl отражает схема: AgCl ↔ Ag+ + Cl-, т. е.: [Ag+] = [Cl-] = x
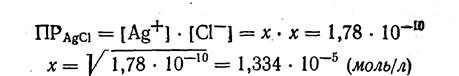
2. Вычислим растворимость AgCl в 0,01 М растворе КС1 без учета коэффициентов активности. Примем концентрацию ионов серебра, получающихся при растворении AgCl, равной х. Тогда концентрация ионов С1- будет равна: 0,01 г-ион/л за счет диссоциации хлорида калия КС1 и х г-ион/л за счет растворимости хлорида серебра AgCl, а всего (0,01 + х) г-ион/л. Следовательно,
[Ag+]= x, [Сl-] = (0,01+x)
ПРAgcl = [Ag+] · [Cl-] = х · (0,01 + х) = 1,78 · 10-10
Так как величина х в выражении концентрации ионов Cl- по сравнению с 0,01 очень мала, то ею можно пренебречь и написать полученное уравнение в следующем виде:
х · 0,01 = 1,78 ·10-10 в 0,01л раствора.
Отсюда х = 1,78 ·10-10 /0,01 = 1,78 ·10-8 (моль/л)
Вычислим растворимость AgCl в 0,01 М растворе КС1 с учетом коэффициентов активности.
Найдем ионную силу раствора m она будет определяться концентрацией (КС1) в растворе. Концентрации же ионов [Ag+] и [С1-], получающихся при растворении AgCl, так малы, что не будут влиять на величину ионной силы раствора. Следовательно.
| m = | ([K+]·12+[Cl-]12)= | (0,01·12+0,01·12)=0,01 | ||
. По таблице 2.2 находим, что для 0,01 н. раствора
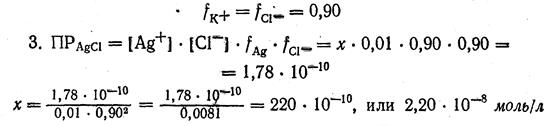
Сопоставляя молярную растворимость хлорида серебра в воде и в 0,01 М растворе хлорида калия КС1, мы видим, что растворимость AgCl в 0,01 М растворе КС1, вычисленная без учета коэффициентов активности приблизительно в 750 раз меньше, чем в чистой воде, а при вычислении с учетом, коэффициентов активности приблизительно в 600 раз меньше, чем в чистой воде:
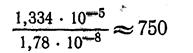
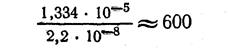
Следовательно, прибавление одноименных ионов оказывает влияние на растворимость малорастворимых электролитов и способствует более полному осаждению твердой фазы, что и используется в анализе.
Солевой эффект
Солевым эффектом называется повышение растворимости малорастворимых солей в системе осадок — раствор при добавлении к ним других сильных электролитов. Установлено, что растворимость сульфата свинца PbSO4 увеличивается при добавлении к его насыщенному раствору, находящемуся в равновесии с осадком, растворов нитрата калия КNO3, нитрата натрия NaNO3, и притом тем сильнее, чем больше концентрация добавляемой соли.
Растворимость хлорида таллия Т1С13 увеличивается при добавлении сульфата калия К2SO4 или нитрата калия KNO3, а растворимость сульфата серебра Ag2SO4 сильно увеличивается при добавлении азотной кислоты НNО3, несколько меньше при добавлении нитрата магния Mg(NO3)2 и еще меньше при добавлении нитрата калия KNO3 (рис. 4.1).
 Это приводит к тому, что растворимость малорастворимого электролита становится больше величины произведения растворимости данного электролита в чистой воде.
Это приводит к тому, что растворимость малорастворимого электролита становится больше величины произведения растворимости данного электролита в чистой воде.
Таким образом, по теории сильных электролитов солевой эффект обусловлен уменьшением коэффициентов активности вследствие повышения ионной силы раствора при добавлении посторонних электролитов. Так как величина ионной силы раствора зависит не только от концентрации, но и от величины зарядов ионов, то разные электролиты, прилитые в одинаковом количестве, дают разный солевой эффект.
Рис.4.1 Влияние кислот и солей
на растворимость Ag2SO4
3 Образование и растворение осадков
Произведение растворимости позволяет по концентрациям реагирующих веществ рассчитывать возможность образования и растворения осадков при протекании реакций обмена, а также вычислять полноту осаждения определяемых ионов.
Допустим, что мы смешиваем раствор соли свинца с любым растворимым хлоридом, например КС1. При этом ионы свинца, сталкиваясь с хлорид-ионами, будут образовывать среднерастворимый электролит хлорида свинца PbCl2. Однако выпадение осадка будет зависеть от произведения активностей ионов aPb2+ · а2Cl- в растворе и величины произведения растворимости хлорида свинца PbCl2, равной 1,6 · 10-5.
Если произведение активностей ионов свинца и хлорид-ионов будет превышать величину ПРPbCl2, осадок PbCl2 будет выпадать, а при обратном соотношении осадок хлорида свинца образовываться не будет. Рассмотрим пример.
Пример 1. Выпадет ли осадок при смешивании 0,05 М раствора ацетата свинца Рb(СН3СОО)2 с 0,5 М раствором хлорида калия КС1?
Решение.
1. Концентрации ионов свинца и хлора в момент сливания будут равны:
[Pb2+] = 2,5 · 10-2 г-ион/л, [Cl-] = 2,5 · 10-1 г-ион/л
2. Произведение концентрации ионов в этом случае равно:
[Pb2+] [C1-]2 = 2,5 · 10-2 · (2,5 · 10-1)2 = 1,56 · 10-3
Полученная величина почти в 100 раз превышает величину произведения растворимости хлорида свинца (1,6 · 10-5). Поэтому раствор окажется пересыщенным в отношении данной соли и часть хлорида свинца выпадет в осадок.
При протекании реакций обмена осадок трудно- и среднерастворимых электролитов образуется в том случае, если произведение концентраций (произведение активностей) ионов в растворе превышает величину его произведения растворимости при данной температуре. Однако выпадение осадка может начаться не сразу после сливания соответствующих растворов, а спустя некоторое время, так как при сливании растворов могут образоваться пересыщенные растворы, которые лишь при стоянии или при потирании стенок пробирки стеклянной палочкой выделяют осадок.
При использовании в анализе амфотерности гидроксидов необходимо знать интервал рН, в котором происходит образование и и полное осаждение их.
Пример 2. При какой величине рН начнется осаждение гидроксида цинка из 0,1 М раствора его соли,
если ПРzn(OH)2 = 7,1 · 10-18.
Решение.
1. Напишем уравнение произведения растворимости гидроксида цинка Zn(ОН)2:
ПР Zn(OH)2 = [Zn2-] · [OH-]2 = 7,1 · 10-18.
2. Найдем концентрацию гидроксид-ионов:

3. По концентрации [OH-] находим величину рОН;
pQH = -lg [ОН-] = -lg 8,42 · 10-9 = 8,075
4. Зная величину рОН, находим рН:
рН = 14 - рОН = 14 - 8,075 = 5,925» 5,9
Итак, осаждение гидроксида цинка Zn(ОН)2 из 0,1 М раствора соли цинка начинается при рН, равном 5,9.
Пример 3. При какой величине рН осаждение гидроксида цинка будет практически полным?
Решение.
1. Из уравнения произведения растворимости гидроксида цинка Zn(ОН)2 находим концентрацию [ОН-], учитывая, что осаждение считается полным, если концентрация осаждаемого иона не будет превышать 1 · 10-6 г-ион/л.
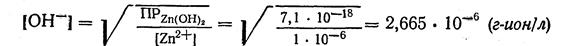
2. Но концентрации [ОН-] находим рОН:
рОН = -lg [ОН-] = -lg 2,665 · 10-6 = 5,57
3. Зная pQH, вычисляем рН:
рН = 14 - рОН = 14 - 5,57 = 8,43
Не меньшее значение в анализе имеет и перевод малорастворимых осадков в раствор.
Допустим, что необходимо растворить осадок гидроксида магния Mg(ОН)2, для того чтобы открыть ион Mg2+ в растворе. Раствор, соприкасающийся с осадком, является насыщенным относительно гидроксида магния Mg(ОН)2. А это значит, что произведение концентраций ионов [Mg2+] · [ОН-]2 равно 6,0 · 10-10. Чтобы растворить осадок, необходимо тем или иным способом нарушить равновесие между осадком и раствором: Mg(ОН)2 ↔ Mg2+ + 2OН-.
осадок раствор
Лучший прием - связывание одного иона в слабоионизирующее соединение. В данном примере, если к раствору прилить кислоты, то ионы водорода взаимодействуют с гидроксид-ионами; тем самым нарушается состояние равновесия:
Mg(OH)2 ↔ Mg2+ + 2OH-
2НС1 ↔ 2С1- + 2H+
¯
2Н2О
В результате протекания этих реакций осадок будет растворяться.
Такого же результата можно добиться путем введения в раствор соли аммония, ионы аммония будут связывать гидроксид-ионы в слабоионизирующее соединение:
Mg(OH)2 ↔ Mg2+ + 2OH-
2NН4С1 ↔ 2С1- + 2NH4+
¯
2NН4ОH
Однако растворяющее действие солей аммония значительно слабее, чем минеральных кислот. Это объясняется тем, что гидроксид аммония NН4ОH диссоциирует значительно сильнее, чем вода, и потому связывание гидроксильных ионов ионами аммония происходит не в полной мере. В солях аммония растворяются лишь некоторые, более растворимые основания (Mg(ОН)2, Mg(ОН)3, Fe(ОН)2 и им подобные).
Малорастворимые основания (Fe(ОН)3, А1(ОН)3, Сr(ОН)3 и др.) легко растворяются в минеральных кислотах, но не растворяются в солях аммония. Малорастворимые кислоты типа Н2SiO3, H2WO4, нерастворимые в воде и минеральных кислотах, легко растворяются в
2 н. растворе гидроксида натрия с образованием растворимых солей, например: Н2SiO3 + 2NaOH ® Na2SiO3 + 2Н2О
H2WO4 + 2NaOH ®Na2WO4 + 2Н2О
Малорастворимые соли слабых кислот растворяются в сильных минеральных кислотах или в сильных кислотах-окислителях. например:
ВаСrО4 + 2НС1 ® BaCl2 + н2сro4
3CuS + 8НNО3 ® 3Сu (NO3)2 + 3S¯ + 2NO + 4Н2О
Малорастворимые соли сильных кислот, например сульфаты щелочноземельных металлов и свинца (BaSO4, SrSO4, PbSO4), галогениды серебра (AgCl, AgBr, AgI) и др., нерастворимые в минеральных кислотах и щелочах, приходится переводить в другие соединения.
Малорастворимые оксиды Аl2О3, Сr2О3, FeO, Fе2О3 и др. сплавляют с гидросульфатом натрия NаНSО4, или гидросульфатом калия KHSO4, или же с пиросульфатом калия К2S2O7. Для этого берут около 20—50 мг хорошо измельченного оксида, помещают в микротигель, добавляют около 0,2 — 0,5 г одной из названных солей и тщательно перемешивают. Затем полученную смесь нагревают (700 °С) до расплавления смеси и получения прозрачного расплава. Если расплавленная масса затвердеет, то после охлаждения добавляют 3—5 капель концентрированной серной кислоты и вновь повторяют сплавление. Остывший плав растворяют при нагревании в воде. Для ускорения растворения можно добавить несколько капель серной или соляной кислоты. Если плав не растворяется в воде и при добавлении кислот, то вещество содержит или кремниевую кислоту H2SiO3, или силикаты, или же диоксид олова SnO2, или сульфаты бария, стронция, свинца. В кислотах не растворяются оксид сурьмы (III) Sb2О3, дисульфид олова SnS2; они растворяются только при продолжительной обработке их царской водкой или смесью Комаровского (концентрированная НС1 с H2O2).
Для растворения диоксида кремния SiO2 и силикатов, не разлагаемых кислотами, пользуются или методом сплавления их с карбонатом натрия и последующей обработкой плава соляной кислотой, или же фтороводородной кислотой.
Исследуемое вещество растирают в тончайший порошок, смешивают в платиновом тигле с 5—6-кратным количеством карбоната натрия Na2CO3 или со смесью карбонатов Na2CO3 и К2СО3 и нагревают на горелке до образования прозрачной массы. Затем платиновый тигель переносят в пламя паяльной горелки и прокаливают в течение 10—15 мин. Чтобы сплавленная масса легко отставала от стенок тигля, его помещают в фарфоровую чашку с холодной дистиллированной водой. Полученный плав обрабатывают хлороводородной кислотой НС1. Выделившуюся метакремниевую кислоту H2SiO3 отделяют центрифугированием, а фильтрат анализируют отдельно.
При обработке силикатов фтороводородной кислотой реакцию ведут в присутствии концентрированной серной кислоты и при нагревании: KtSiO3 + 6HF ® KtF2 + SiF4 + 3Н2О
После 2—3-кратного выпаривания смеси и полного удаления четырехфтористого кремния SiF4 оставшийся осадок растворяют в воде и проводят анализ раствора.
Для растворения труднорастворимых солей часто пользуются реакциями комплексообразования.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 17248; Нарушение авторских прав?; Мы поможем в написании вашей работы!