
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисление рН буферных систем, образованных слабыми основаниями и их солями
|
|
|
|
Для примера возьмем аммиачную буферную систему, представляющую смесь растворов гидроксида аммония NH4OH и хлорида аммония NН4С1.
1. Запишем уравнение константы ионизации NH4OH и найдем [OН-]:
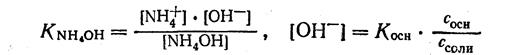
2. Отсюда находим:

Пример 5. Вычислить рН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония NH4OH и хлорида аммония NH4C1. Как изменится рН при добавлении, к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если КNн4он = 4,75?
Решение.

При добавлении к буферному раствору 0,1 М НС1 концентрация NH4OH уменьшится на 0,1 м и станет равной 0,4 М, а концентрация NН4Сl возрастет до 0,6 М. Следовательно,

При добавлении же 0,1 М NaOH к 1 л смеси концентрация NH4OH увеличится до 0,6 М, а концентрация NH4C1 уменьшится до 0,4 М, в результате этого получим:
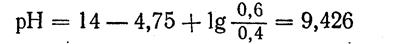
При разбавлении буферного раствора водой в 10 раз будем иметь:

Пример 6. Вычислить рОН и рН раствора, содержащего в 1л 8,5 г аммиака NH3 и 107 г хлорида аммония.
Решение.
1. Находим молярные концентрации аммиака и хлорида аммония:
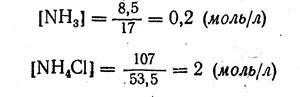
2. Вычисляем величину рОН:
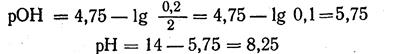
Буферная емкость
Способность буферных систем сохранять постоянство рН определяется его буферной емкостью. Она измеряется количеством грамм-эквивалентов сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной системы раствора, чтобы изменить его рН на единицу. Буферная емкость тем больше, чем выше концентрация компонентов буферной смеси. По мере добавления к буферному раствору кислоты или щелочи устойчивость раствора к изменению рН постепенно уменьшается вследствие уменьшения концентрации одного из компонентов. Чтобы действие буферной системы было достаточно эффективным, т. е. чтобы буферная емкость раствора изменялась не слишком сильно, концентрация одного компонента не должна превышать концентрацию другого компонента больше чем в 10 раз.
Буферные системы широко и разносторонне используются в аналитической химии. Состав буферных систем довольно разнообразен, поэтому имеется широкий выбор их. Для создания и поддержания величины рН к исследуемому раствору добавляют ту или иную буферную смесь. Так, аммиачная буферная система используется для осаждения гидроксида алюминия, который при применении чистого раствора аммиака частично растворяется в его избытке.
Ацетатный буферный раствор используется при осаждении ионов бария бихроматом калия в присутствии ионов стронция и кальция. Формиатный буферный раствор используется для осаждения ионов цинка сероводородом.
Многие аналитические реакции с органическими реактивами, характеризующиеся образованием окрашенных соединений, проводятся при строго определенной величине рН. Например, при обнаружении катиона Ni2+ диметилглиоксимом (реактив Чугаева) используется ацетатная буферная система с рН = 5.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 6738; Нарушение авторских прав?; Мы поможем в написании вашей работы!